シナプス前終末におけるシナプス小胞プール形成へのα-シヌクレインの役割が明らかに〜研究成果がBiochimica et Biophysica Acta (BBA) – Molecular Basis of Diseaseに掲載
シナプス前終末におけるシナプス小胞プール形成へのα-シヌクレインの役割が明らかに ~多くの神経変性疾患解明への応用に期待~
順天堂大学医学部薬理学講座 鈴木ちぐれ 特任准教授、大学院医学研究科研究基盤センター形態解析イメージング研究室 山口 隼司 助教、老人性疾患病態・治療研究センターの内山 安男 特任教授、谷田 以誠 先任准教授らの研究グループは、順天堂大学医学部神経学講座の服部 信孝主任教授、波田野 琢先任准教授、星薬科大学薬理学研究室(成田 年教授)須田 雪明助教の研究グループとの共同研究で蛍光タンパク質で標識したα-シヌクレイン*1を過剰発現させたマウスを作成し、最新技術である高精度光線-電子相関顕微鏡法*2や免疫電子顕微鏡法*8を用いて小脳のシナプス前終末におけるシナプス*3小胞プール形成へのα-シヌクレインの役割を生体内で目に見える形で明らかにすることに成功しました。これにより、これまで明らかにされてこなかったα-シヌクレインのシナプス前終末における存在意義の一端が明らかになりました。このマウスは、抗原抗体反応を介せずとも直接α-シヌクレインの局在を蛍光顕微鏡像と電子顕微鏡像と相関して解析できることから、病態におけるα-シヌクレインの関与する超微形態変化の解析やα-シヌクレイン関連神経疾患の病態モデルと組み合わせることで、パーキンソン病を始め様々な神経変性疾患の病態解明への応用が期待されます。本論文はBiochimica et Biophysica Acta (BBA) – Molecular Basis of Diseaseのオンライン版に2024年9月4日にオンライン公開されました。
プレスリリースURL:https://www.

背景 α-シヌクレインはパーキンソン病との関連が認められた原因遺伝子の一つで、成熟した神経細胞のシナプス前終末に局在するタンパク質です。パーキンソン病以外にもシヌクレイノパチー 、アルツハイマー病、レビー小体認知症 、多系統萎縮症など様々な神経疾患において神経細胞に異常なα-シヌクレインが蓄積していて神経変性の誘導に関わると考えられています。しかしながら、正常中枢神経組織におけるα-シヌクレインの機能についても未だよくわかっていませんでした。
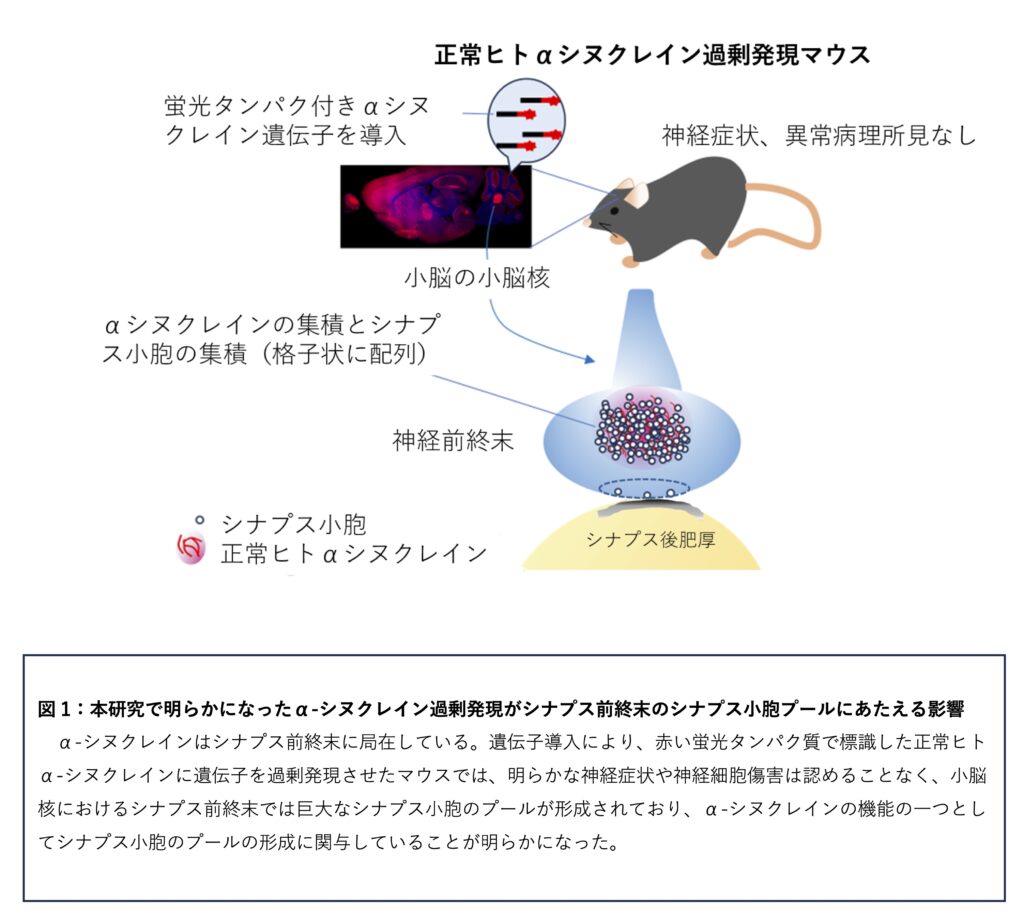 内容 研究グループは、脳内の神経細胞におけるα-シヌクレインの局在と機能を調べるために、赤い蛍光タンパクで標識した正常ヒトα-シヌクレインを過剰発現させたマウスを作成して、脳組織内のα-シヌクレインの局在と同部位の超微形態を新技術の高精度光線-電子相関顕微鏡法を用いて解析しました。
内容 研究グループは、脳内の神経細胞におけるα-シヌクレインの局在と機能を調べるために、赤い蛍光タンパクで標識した正常ヒトα-シヌクレインを過剰発現させたマウスを作成して、脳組織内のα-シヌクレインの局在と同部位の超微形態を新技術の高精度光線-電子相関顕微鏡法を用いて解析しました。
作成したα-シヌクレイン過剰発現マウスに神経変性疾患の症状がないかを調べました。このマウスは正常に生まれ、成長し、生後1年を過ぎても明らかな成長障害や神経症状は認められませんでした。脳組織を蛍光顕微鏡で観察したところ、α-シヌクレインの蛍光シグナルは脳組織全般に認められ、特に嗅球、線条体、海馬、視床、黒質及び小脳皮質、小脳核で強い蛍光を発していました。
神経変性疾患では異常なα-シヌクレインが凝集、蓄積することが知られています。異常なα-シヌクレイン凝集体は、1% Triton X-100*4に不溶性ですが、α-シヌクレイン過剰発現によりマウス脳組織内に1% Triton X-100不溶性のα-シヌクレインは認められませんでした。さらに、タンパク凝集体マーカーであるp62*5やユビキチン*6もコントロールマウスとの差を認めないことから、α-シヌクレイン-mKate2過剰発現によるα-シヌクレインの病的な凝集体の形成はないことが示されました。
そこで小脳におけるα-シヌクレインに注目して蛍光顕微鏡を用いて解析したところ、シナプス小胞マーカーとなるシナプトフィジン*7陽性シグナルがα-シヌクレインの蛍光シグナルと同じ部位に局在していました。In-resin CLEMと電子顕微鏡を用いた解析からはα-シヌクレインの蛍光シグナル陽性の大型のシナプス前終末が小脳核の神経細胞周囲とPurkinje細胞近傍に認められ、その内部には大量のシナプス小胞が格子状に集積した像が認められました。また、免疫電子顕微鏡による解析では、α-シヌクレイン陽性およびα-シヌクレインの蛍光タンパク陽性の金コロイドはシナプス小胞の膜上に局在していました。
α-シヌクレインはシナプス前終末におけるシナプス小胞のリサイクルと神経伝達物質の放出にかかわっていると考えられています。シナプス前終末にはシナプス小胞がプールされる部位が3か所あり、1つめは放出可能プール(ready releasable pool)で、 アクティブゾーン*9と呼ばれる、神経伝達物質が放出される領域に係留されており、刺激に伴って速やかに開口放出されるシナプス小胞プールです。2つめは再循環プール (recycling pool)で、細胞膜に近接して存在しており、中等度の刺激を受けてシナプス小胞の放出と形成の循環を開始します。このプールは放出可能プールより大きいのですが刺激を受けてから反応するまでに時間がかかります。3つめが、貯蔵プールです。貯蔵プールのシナプス小胞は通常の条件下では神経伝達物質の放出は行わず、シナプス小胞が集積しています。シナプス小胞は、貯蔵プールにある状態から、軸索終末の細胞膜近傍のアクティブゾーンに移動し、速やかに開口放出できるように準備します。貯蔵プールのシナプス小胞は放出可能プールの小胞が枯渇するまで動きません。これら、3つのシナプス小胞プール形成へのα-シヌクレイン の関与はまだよくわかっていませんでした。今回、α-シヌクレイン過剰発現マウスの電子顕微鏡連続切片を用いて小脳核のシナプス前終末の立体再構築を行うと大量の小胞の集積として観察されるシナプス小胞プールは、コントロールに比べ約4倍の大きさになっていましたが、神経伝達物質の放出にかかわるアクティブゾーンの長さやアクティブゾーン近傍のシナプス小胞の数にはほとんど影響がありませんでした。また、観察されたシナプス小胞プールでは、シナプス小胞が精緻に並んだ状態でプールを形成していました。
これらの結果より、α-シヌクレインはシナプス前終末におけるシナプス小胞の貯蔵プールの形成に関与しており、α-シヌクレインの過剰発現においてもアクティブゾーンにおけるシナプス小胞の分布にはほとんど影響を与えないことわかりました。
今後の展開
今回、研究グループは蛍光タンパク質で標識した正常ヒトα-シヌクレイン過剰発現マウスを用いてシナプス前終末におけるα-シヌクレインが関与する膜構造について解析を行いました。このマウスは生体にてα-シヌクレインを蛍光顕微鏡および高精度光線-電子相関顕微鏡法による解析が可能なマウスであるため、異常なα-シヌクレインが蓄積したときのシナプス前終末におけるシナプス小胞プールの形成異常など、神経変性に関わる各種病態モデルと組み合わせることで、現在、根本的な治療法のないα-シヌクレイン関連疾患の病態解明と新たな治療法の発見に寄与できると期待されます。

 原著論文
原著論文
タイトル:Direct evidence for ultrastructures of the α-synuclein-associated synaptic vesicle pool in presynaptic terminals.
タイトル(日本語訳): α-シヌクレインのシナプス前終末のシナプス小胞プール形成への関わり。~αシヌクレイン過剰発現マウスを用いた超微形態解析
著者:Chigure Suzuki, Junji Yamaguchi, Shun Mitsui, Takahito Sanada, Juan Alejandro Oliva Trejo, Soichirou Kakuta, Kenichi Tanaka, Yukari Suda, Taku Hatano, Nobutaka Hattori, Isei Tanida, Yasuo Uchiyama
著者(日本語表記): 鈴木 ちぐれ1),2),3), 山口 隼司1),4), 三井 駿1), 真田 貴人1), Juan Alejandro Oliva Trejo 1), 角田 宗一郎 1), 4), 田中 謙一5), 6), 須田 雪明5), 6), 波田野 琢 7), 服部 信孝7), 谷田 以誠 1), 内山 安男 1)
著者所属:1)順天堂大学大学院医学研究科 老人性疾患病態・治療研究センター 神経疾患病態構造学、2) 順天堂大学医学部薬理学講座、3) 順天堂大学ダイバーシティ推進センター、4)順天堂大学大学院医学研究科研究基盤センター 形態解析イメージング研究室5) 星薬科大学薬理学研究室6) 国立がん研究センター研究所がん患者病態生理 7) 順天堂大学大学医学部神経学講座
https://doi.org/10.1016/j.bbadis.2024.167494
