最新技術で中枢神経系細胞の異常な超微形態変化が明らかに ~多くの病因解明への応用に期待~ 研究成果がGliaに掲載
最新技術で中枢神経系細胞の異常な超微形態変化が明らかに ~多くの病因解明への応用に期待~
PD 三井 駿博士を中心とした我々の研究がGlia誌のオンライン版に2023年8月12日にオンライン公開されました。
プレスリリースはこちら。
研究グループは、最新技術である免疫高精度光線-電子相関顕微鏡法を用いて神経セロイドリポフスチン症モデルマウスにおける、神経変性発症時の神経細胞の脱落、それに伴い活性化するミクログリア、アストロサイトの超微形態変化を捉えることに成功し、これまでに明らかにされてこなかったミクログリアに取り込まれたTUNEL陽性の構造体やリソソーム内の異常蓄積物、アストロサイトにみられるp62陽性構造体を明らかにしました。この研究は、抗原抗体反応を電子顕微鏡解析に応用できることから、病態マウスモデルや、神経変性疾患を含むヒト病理組織における変性部位の細胞内異常まで明らかにできる可能性が高く、多くの病因解明への応用が期待されます。
背景
脳組織は神経細胞による複雑なネットワークとグリア細胞による神経細胞の維持や機能発現・代謝支援により、その機能を発揮しています。神経変性疾患においては神経細胞の死や脱落がおこるとともに、グリア細胞であるミクログリアやアストロサイトが活性化します。通常、ミクログリアは変性した神経細胞のクリアランスをおこない、アストロサイトは脱落した神経細胞領域の組織を支持すると言われています。神経変性疾患を引き起こす神経セロイドリポフスチン症(バッテン病)モデルマウスは、オートファジー・リソソーム分解系に関わるカテプシンDが欠損しており、神経セロイドリポフスチン症患者と同様の表現型を示す世界で唯一のモデルマウスです。このマウスでは、神経細胞の脱落とともに活性化したミクログリアやアストロサイトが増加しますが、その内でどのような変化・異常が起こっているのかは良くわかっていませんでした。
内容
研究グループは、これまで神経セロイドリポフスチン症モデルマウスを用いて、神経変性疾患におけるオートファジー・リソソーム分解系の影響を解析してきました。このモデルマウスの中枢神経組織には自家蛍光を発するセロイドリポフスチンが蓄積しており、変性した神経細胞においてGROD(granular osmiophilic deposits)と呼ばれる異常なリソソームやオートファジー小胞の蓄積が認められます。このマウス脳の視床では生後24日で、神経細胞の数が約半分に減少するとともに、活性化ミクログリアは約2.5倍、活性化アストロサイトは約4.6倍に増加していました。
そこで、研究グループは、最近開発した免疫高精度光線-電子相関顕微鏡法を用いて、このマウス視床における活性化ミクログリア・アストロサイトの超微形態変化を解析しました。従来の解析法である蛍光顕微鏡解析では、脳組織におけるそれぞれの細胞の位置や増減は観察できますが、細胞内の超微形態変化を捉えることは困難です。また、電子顕微鏡解析では、局所的な微細構造は捉えられますが、複雑なネットワークを形成する脳組織においてグリア細胞全体を捉えることは困難です。免疫高精度光線-電子相関顕微鏡法は、蛍光顕微鏡の高い位置精度と電子顕微鏡の微細構造解析を兼ね備えた手法です。
まず、神経セロイドリポフスチン症患者脳において、電子顕微鏡解析で認められるGRODと呼ばれる異常なリソソームとミクログリアの関係について調べました。GRODはオートファジー・リソソーム分解系がうまく機能できない変性した神経細胞の細胞体に認められます。そして変性した神経細胞はミクログリアに貪食されると考えられています。ミクログリアは活性化すると伸展した突起を伸ばしますが、ミクログリアの突起が変性した神経細胞体を取り囲み、ミクログリアの細胞体にGRODが取り込まれている様子が認められました。
また神経セロイドリポフスチン症モデルマウスでは、オートファジー・リソソーム分解系の異常により、オートファジーアダプタータンパク質、p62 が蓄積しています。このp62およびリソソームについて調べると、ミクログリアではリソソームは増加し、リソソーム内に異常なオートファジー空胞が蓄積していましたが、p62凝集体はほとんど認められませんでした。
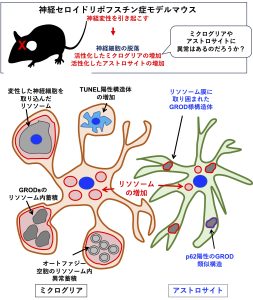
神経セロイドリポフスチン症モデルマウス脳ではTUNEL陽性シグナルが認められ、一般には、TUNEL陽性シグナルは細胞死の1種、アポートシスを検出すると考えられています。そこで、TUNEL陽性シグナルが、このマウス脳の神経細胞、ミクログリア、アストロサイトのうちのどの細胞で多く認められるかを調べたところ、TUNEL陽性シグナルは主にミクログリアに認められました。しかしながら、ミクログリア自体には、リソソームの異常はなく、活性化して増加しているため、アポトーシスを起こしているとは考えにくい状態です。変性した神経細胞がミクログリアのリソソームに取り込まれて、変性した神経細胞由来の核がTUNEL陽性になっている可能性があります。そこで、免疫高精度光線-電子相関顕微鏡法を用いて解析したところ、変性した神経細胞由来の核がミクログリアのリソソームに取り込まれ、核そのものではなく、核から断片化したDNAがTUNEL陽性になっていることがわかりました。
一方、アストロサイトでは、リソソーム、p62凝集体ともに増加しており、リソソーム膜に取り囲まれたGROD様構造体や、細胞質にp62陽性のGRODに類似した凝集体が認められました。
以上の結果から、神経セロイドリポフスチン症モデルマウスにおいては、神経細胞の変性に加えて、ミクログリアやアストロサイトにも異常が起こっていることがとわかりました。
今後の展開
今回、研究グループは免疫高精度光線-電子相関顕微鏡法を用いて神経変性疾患様表現型を示す神経セロイドリポフスチン症モデルマウスのグリア細胞について解析を行いました。神経変性研究では変性する神経細胞に注目しがちですが、今回の研究でグリア細胞でも異常が起こっていることがわかり、脳組織における神経変性研究の複雑さを痛感しました。今後は、この解析技術を用いて神経変性以外の病態モデルマウスについても研究を行い、多くの疾患の病因解明への貢献が期待されます。
原著論文
タイトル:TUNEL-positive structures in activated microglia and SQSTM1/p62-positive structures in activated astrocytes in the neurodegenerative brain of a CLN10 mouse model.
タイトル(日本語訳): 神経変性疾患CLN10マウスモデル脳における活性化ミクログリアのTUNEL陽性構造体および活性化アストロサイトにおけるp62/SQSTM1陽性構造体
著者:Shun Mitsui, Junji Yamaguchi, Chigure Suzuki, Yasuo Uchiyama, Isei Tanida.
著者(日本語表記): 三井 駿1)、山口隼司1),2)、鈴木ちぐれ1),3),4)、内山安男1)、谷田以誠1)、
著者所属:1)順天堂大学大学院医学研究科 老人性疾患病態・治療研究センター 神経疾患病態構造学、2)順天堂大学大学院医学研究科研究基盤センター 形態解析イメージング研究室、3) 順天堂大学医学部薬理学講座、4) 順天堂大学ダイバーシティ推進センター
DOI: https://doi.org/10.1002/glia.24449
本研究は国立研究開発法人日本医療研究開発機構 (AMED)研究費 (21gm5010003、22gm1710001 s0201)、文部科学省私立大学戦略的研究基盤形成支援事業、日本私立学校振興・共済事業団、日本学術振興会 (JSPS) 科研費 (20K22744, 21K15198, 22K07376, 20H05342, 21H02435, 22H02872, 22H04652)、順天堂大学老人性疾患病態・治療研究センター研究奨励費、順天堂大学老人性ゲノム・再生医療センター研究奨励費の支援を受けて、実施されました。
