研究グループ
研究の概要
ハウスダストや花粉に含有される抗原が皮膚や気道上皮などのバリア組織から侵入すると、自然免疫系が活性化し感作が始まります。その後、同一または別のバリア組織から抗原が再侵入し、発症に至ります。この過程には多様な細胞や分子が介在します。私達の研究グループでは、原因抗原(アレルゲン)の性状や皮膚バリアの破壊に着目することにより、バリアを起点とする自然免疫・獲得免疫の活性化と発症の機序解明を進めています。ここで得られる知見は、ひいてはアレルギーの新しい治療・診断・予防法につながる可能性を秘めています。
研究の背景・目的
ハウスダストやスギ花粉など(allergen sources =アレルゲンの源)が皮膚や気道上皮に接触して抗原(アレルゲン)が侵入すると、自然免疫系が活性化し感作過程が開始されます。
抗原感作の成立後、同一または別のバリア組織(気道・皮膚・消化管・結膜)がアレルゲンに再曝露されると発症に至ります。近年、皮膚からのアレルゲン感作(経皮感作)の重要性が注目されています。例えば家庭内のハウスダストにはダニが生息・繁殖することはよく知られていますが、食べ物の屑も含まれています。これらに対して経皮感作が成立してしまうと、ハウスダストの吸入で喘息を発症し、感作食物を経口摂取した際に消化管アレルギーを発症したりします。乳幼児期のアトピー性皮膚炎を起点として、その後、喘息・鼻炎・食物アレルギーなど他種のアレルギー疾患を発症し、感作抗原の種類も拡大していく現象が臨床的に観察されますが(いわゆるアレルギーマーチ)、それはこのような仕組みで起きると考えられています。
感作・発症の機序はバリア組織ごとに共通点とともに異なる点も存在すると考えられます。どのバリア組織においても共通する重要な3つのステップとして、(1) 環境因子や遺伝によるバリア機能の低下、(2) バリア組織でのデンジャーシグナル・サイトカイン・各種メディエーターの放出・産生、そして (3) 自然免疫細胞(自然リンパ球など)および獲得免疫細胞(ヘルパーT細胞など)の活性化が挙げられます。この過程には多様な細胞や分子が介在します。
一方、私達のからだは過剰な応答を抑えるしくみ元々備えており、この調節システムを活性化することが治療・予防戦略の鍵になると考えられます(制御性T細胞など)。アレルゲンを投与して耐性を誘導するアレルゲン免疫療法は、100年以上の歴史がありますが、現在でも唯一の根治療法です。
なぜアレルゲンはアレルゲンになるのか?アレルゲンや共在微生物(アトピー性皮膚炎における黄色ブドウ球菌など)はバリア破壊や種々の細胞応答を誘導する生物活性を有しており、その役割と機序を明らかにすることも重要です。私達は、特に現実のアレルゲンや共在微生物(プロテアーゼ抗原、花粉粒子、黄色ブドウ球菌、TLRリガンドなど)に由来する生物活性やバリア破壊に着目することにより、自然免疫・獲得免疫の活性化と発症機序の解明、ひいては新規介入法の提案を目的として研究を進めています。未だに多くの不明点があるエキサイティングな領域です。新しい実験動物モデルを作成し、解析を進めていると、びっくりするような現象に遭遇することがあります。その背後にいったいどんなしくみがあるのでしょうか。私達と一緒にその扉を開いてみませんか?
(連絡先)t-takai@juntendo.ac.jp
キーワード: 感作; 発症; バリア組織; バリア機能の低下; デンジャーシグナル放出・サイトカイン産生; ヘルパーT細胞; 自然リンパ球; アレルゲン由来因子; 共在微生物由来因子; アレルゲン免疫療法; アレルギーマーチ
これまでの研究成果
本研究により、ダニ・花粉・黄色ブドウ球菌はプロテアーゼ等のアジュバント物質を生産・含有し、獲得免疫を介さずに上皮および皮膚バリアを破壊するとともに種々の細胞を刺激・活性化することによって、炎症惹起と獲得免疫の成立・拡大を促進するという構図が示されつつあります(下図)。現在は主に実験動物モデルを利用して、機序に関する研究を継続しています。
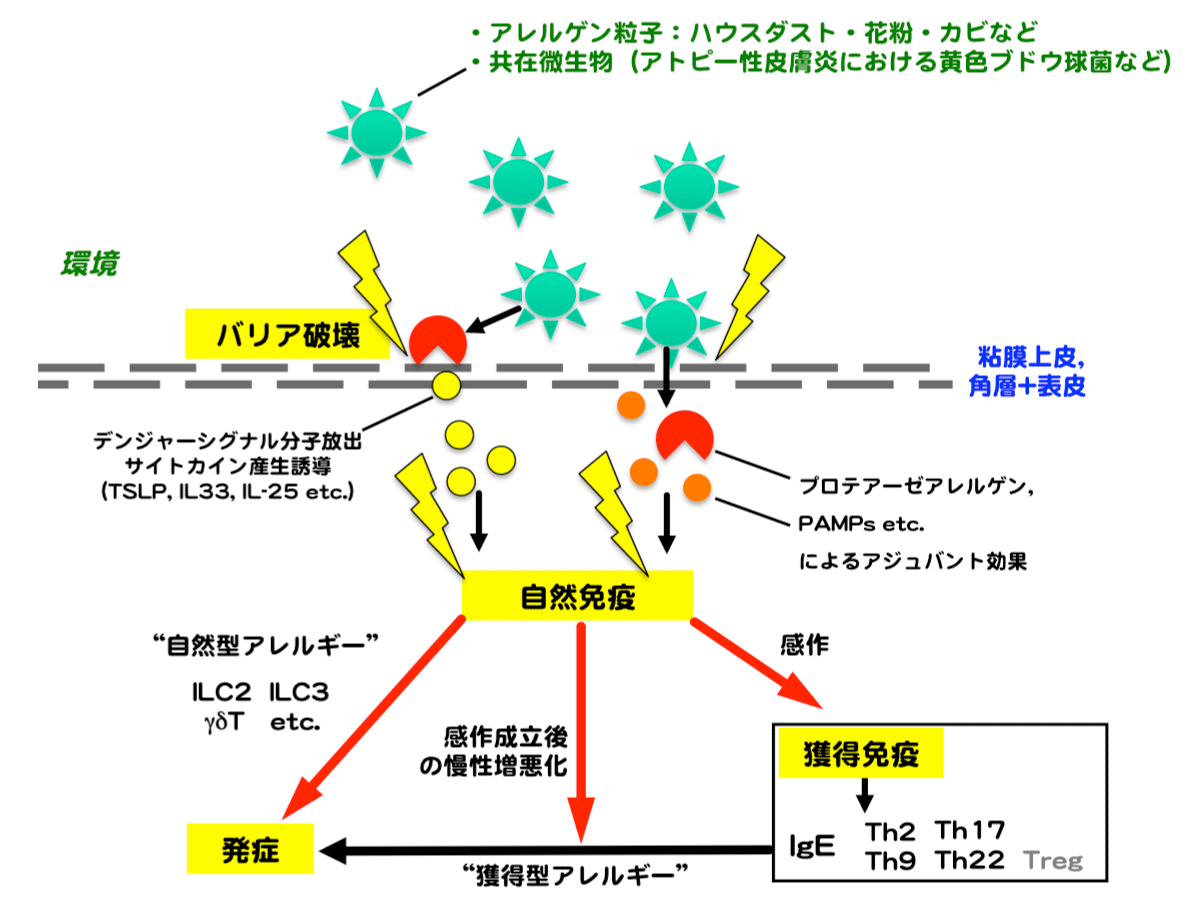
本研究に関する現在までの研究成果の概要は以下の通りです。
プロテアーゼ抗原
花粉
黄色ブドウ球菌
TLRリガンド
治療用ダニアレルゲンの標準化
<プロテアーゼ抗原>
- プロテアーゼ活性を有する組換体ダニ主要アレルゲン(Der f 1, Der p 1)の解析 [Takai et al. J Allergy Clin Immunol 2005など] から出発し、それらを活用したアレルゲンのアジュバント活性に関する研究に着手 [Kikuchi et al. J Immunol 2006など]
- ダニ主要アレルゲンDer f 1, Der p 1がプロテアーゼ活性依存的に皮膚バリア破壊活性 [Nakamura et al. J Invest Dermatol 2006] およびヒト表皮角化細胞刺激活性 [Kato et al. J Allergy Clin Immunol 2005など] を発揮することを先駆けて報告
- 実験動物(マウス)を利用したin vivo解析へと研究を発展させ、皮膚を介したプロテアーゼ抗原感作モデルを用いた解析を進めている [Iida et al. Allergol Int 2014; Shimura et al. J Invest Dermatol 2016; Yoshimura et al. J Invest Dermatol 2023など]
- 経鼻曝露モデルの構築と解析により、獲得免疫依存の好酸球性気道炎症誘導・Th2/IgE誘導において抗原のプロテアーゼ活性が重要であることを先駆けて報告 [Kamijo et al. J Immunol 2013; Maruyama et al. Allergy 2019]
- 経皮感作後の気道炎症誘導・特異的IgE維持(アレルギーマーチモデル)において抗原のプロテアーゼ活性が重要であることを先駆けて報告 [Nishioka et al. J Allergy Clin Immunol 2018]
- プロテアーゼ抗原(ダニおよびパパイン)・花粉粒子・サイトカインによる好塩基球活性化機序[Kamijo et al. J Allergy Clin Immunol 2016]
<花粉>
- 種々の花粉粒子に含有されるプロテアーゼ活性, NADPHオキシダーゼ活性, 脂質の解析 [Gunawan et al. Allergol Int 2008など]
- スギ・ヒノキ花粉粒子が樹状細胞活性化能とin vivoでのアジュバント活性を有することを先駆けて報告 [Kamijo et al. J. Immunol 2009]
<黄色ブドウ球菌>
- 黄色ブドウ球菌由来プロテアーゼが皮膚バリア破壊を有することを先駆けて報告 [Hirasawa et al. J Invest Dermatol 2010]
- 黄色ブドウ球菌細胞膜成分がTLR2-TLR6依存的にヒト表皮角化細胞のTSLP産生 (Th2分化に重要なサイトカイン)を誘導することを明らかにした [Vu et al. J Allergy Clin Immunol 2011など]
<TLRリガンド>
- TLR3, TLR5, TLR2-TLR6のリガンドがヒト表皮角化細胞のTSLP産生を誘導し、Thサイトカインによる増強・抑制を受けることを明らかにした [Kinoshita et al. J Allergy Clin Immunol 2009など]
- TLRリガンドおよびサイトカイン刺激によるヒト表皮角化細胞のTSLP産生は、TSLP mRNAのshort formではなくlong formの誘導によるものであることを示した [Xie et al. J Dermatol Sci 2012]
<治療用ダニアレルゲンの標準化>
- 日本アレルギー学会のダニ抗原標準化タスクフォースのメンバーとして、日本のアレルゲン免疫療法に使用されるダニ抗原エキス(ヤケヒョウヒダニおよびコナヒョウヒダニ)の標準化作業を共同で実施・完了 [Takai et al. Allergol Int 2015; 高井ら アレルギー 2014]。日本国内におけるアレルゲン免疫療法(皮下注射あるいは舌下投与)に使用される製品の表示力価は、これに準拠して決定されています。
