研究テーマ
1.表皮内神経線維2.オピオイドペプチド-オピオイド受容体3.上皮ー神経ー免疫コミュニケーション4.かゆみのバイオマーカーに関する研究5.かゆみの解析ツール6.その他の痒みのメカニズム、メディエーターに関する研究7.その他の皮膚科学研究8.共同研究実績
メンバー
メンバー
-
所長髙森 建二順天堂大学 名誉教授・特任教授
学校法人順天堂 理事【経歴】
1967年3月 順天堂大学医学部卒業 1967年4月 順天堂大学医学部生化学・専攻生 1971年4月 順天堂大学医学部生化学・助手 1976年4月 順天堂大学医学部第2生化学・講師 1977年9月 米国Duke大学医学部皮膚科 Research Associate 1980年4月 順天堂大学医学部皮膚科学・助手 1982年4月 越谷市立病院皮膚科・部長 1983年4月 順天堂大学医学部皮膚科・講師 1987年3月 順天堂大学医学部皮膚科・助教授 1993年10月 順天堂大学医学部皮膚科・教授 2002年4月 順天堂大学医学部附属浦安病院・副院長 2005年4月 順天堂大学医学部附属浦安病院
院長(2012年3月迄)
学校法人順天堂・理事(現在に至る)
学校法人順天堂・評議員(現在に至る)2007年4月 順天堂大学・名誉教授(現在に至る) 2007年10月 順天堂大学大学院医学研究科
皮膚科学・特任教授(現在に至る)2008年9月 順天堂大学大学院医学研究科
環境医学研究所・所長(現在に至る)2019年8月 順天堂かゆみ研究センター
センター長(現在に至る) -
先任准教授冨永 光俊環境医学研究所 先任准教授
【経歴】
2005年 東京理科大学大学院基礎工学研究科
生物工学専攻博士後期課程・学位:博士(工学)2005年 順天堂大学大学院医学研究科
環境医学研究所・博士研究員2009年 順天堂大学大学院医学研究科・学位:博士(医学) 2010年 日本学術振興会特別研究員(PD) 2011年 米国カリフォルニア大学デービス校
(Carstens Lab)客員研究員2012年 順天堂大学大学院医学研究科
環境医学研究所・助教2014年 順天堂大学大学院医学研究科
環境医学研究所・准教授2017年 順天堂大学大学院医学研究科
環境医学研究所・先任准教授 (現在に至る) -
准教授鎌田 弥生環境医学研究所 准教授
【経歴】
2011年 北里大学大学院医療系研究科博士課程修了
学位:博士(医学)2011年 北里大学大学院医療系研究科生体制御
生化学・研究員2012年 順天堂大学大学院医学研究科
環境医学研究所・博士研究員2013-2015年 日本学術振興会 特別研究員PD 2016年 順天堂大学大学院医学研究科
環境医学研究所・博士研究員2017年 順天堂大学大学院医学研究科
環境医学研究所・助教2022年 順天堂大学大学院医学研究科
環境医学研究所・准教授 (現在に至る) -
准教授吉川 宗一郎環境医学研究所 准教授
-
准教授(併任)古宮 栄利子薬学部 准教授
環境医学研究所 准教授(併任) -
准教授(併任)白鳥 美穂薬学部 准教授
環境医学研究所 准教授(併任) -
特任助教外山 扇雅環境医学研究所 特任助教
-
助教(非常勤)本田 耕太郎環境医学研究所 助教(非常勤)
-
博士研究員趙 巧鳳環境医学研究所 博士研究員
-
博士研究員飛田 知央環境医学研究所 博士研究員
-
博士研究員森田 元樹環境医学研究所 博士研究員
-
博士研究員長尾 圭環境医学研究所 博士研究員
-
大学院生宇藤 優環境・性差医学 博士課程4年生
-
大学院生田中 優希環境・性差医学 博士課程3年生
-
大学院生上野 桃環境・性差医学 博士課程3年生
-
リサーチアシスタント左 穎環境・性差医学 博士課程3年生
-
大学院生須賀 望環境・性差医学 博士課程2年生
-
大学院生種元 七海環境・性差医学 修士課程2年生
-
大学院生堀田 真央環境・性差医学 修士課程2年生
-
協力研究員Catharina Sagita Moniaga環境医学研究所 協力研究員
-
協力研究員髙橋 伸明科研製薬株式会社
-
協力研究員岩永 知幸ポーラ化成工業株式会社
-
協力研究員松本 朋大花王株式会社
-
協力研究員後藤 悠ポーラ化成工業株式会社
-
協力研究員中村 知矢王子ファーマ株式会社
-
協力研究員今田 敏博王子ファーマ株式会社
-
協力研究員佐々木 紫保王子ファーマ株式会社
-
協力研究員内藤 ひかり王子ファーマ株式会社
-
協力研究員宮田 民恵株式会社ファンケル
-
協力研究員吉野 崇株式会社ファンケル
-
協力研究員佐藤 暢彦株式会社ファンケル
-
協力研究員枝 亜希子株式会社ファンケル
-
協力研究員山田 祐太朗株式会社ファンケル
-
協力研究員藤田 未麗株式会社ファンケル
-
協力研究員佐々木 美帆株式会社エテルナム
-
協力研究員上田 向勇株式会社エテルナム
-
協力研究員内海 潤環境医学研究所・協力研究員
-
助教岸 龍馬順天堂大学医学部附属浦安病院 皮膚科学講座
-
助教加藤 塁順天堂大学医学部附属浦安病院 皮膚科学講座
-
助教小島 豪順天堂大学医学部附属浦安病院 皮膚科学講座
-
助教豊澤 優衣順天堂大学医学部附属浦安病院 皮膚科学講座
-
講師(非常勤)木村 有太子順天堂大学医学部皮膚科学講座 講師(非常勤)
-
助教(非常勤)黒崎 裕子順天堂大学医学部附属浦安病院
皮膚科・助教(非常勤) -
助教(非常勤)岩本 志穂順天堂大学医学部内科学教室・消化器内科学講座 非常勤助教
-
助教(非常勤)鶴町 宗大順天堂大学
-
助教(非常勤)河村 麻佑順天堂大学医学部附属浦安病院 皮膚科学講座
-
准教授加茂 敦子順天堂大学医療看護学部
准教授
共同研究者
-
助教梅原 芳恵順天堂大学大学院医学研究科アトピー疾患研究センター
助教 -
講師石氏 陽三東京慈恵会医科大学皮膚科学講座
講師 -
准教授川崎 広明昭和女子大学 生活科学部 管理栄養学科
准教授
OB/OG
-
Suhandy TengaraStudy Coordinator at Australian Clinical Research Network
-
種田 研一
-
鳥越 桂医)渋美会 城東在宅医療クリニック(常勤)
国立がん研究センター東病院
麻酔科集中治療科 医員(非常勤) -
根木 治根木医院
順天堂大学医学部附属浦安病院皮膚科(非常勤) -
飯泉 恭一柴田学園大学
准教授 -
坂口 安澄
-
大津 彩夏日東電工株式会社
-
楠部 史也科研製薬株式会社
-
幸坂 涼平
-
横田 将史花王株式会社
研究内容
私たちのグループでは、痒みの発生機序を基礎的に研究し、難治性痒みを伴う様々な疾患の病態の解明と予防・治療法の開発を目指し、現在、以下の研究を推進しています。
1.表皮内神経線維
アトピー性皮膚炎(AD)、乾皮症などの皮膚には、知覚神経線維の表皮内への侵入・増生が認められます(図1)。このような神経線維は外界と生体の境界部である角層直下にまで侵入してくることから、外部からの痒み刺激に対し容易に興奮することが推察され、これが痒み閾値の低下(過敏性)、また痒みの難治化につながると考えています。
これまでの我々の研究から、1)表皮内への神経線維の侵入・増生メカニズム、2)表皮内神経線維に対する各種治療法の効果、が明らかになりました。さらに、以上の結果を踏まえ、3)ADモデルマウスの病態に対するSemaphorin3A軟膏の有効性を検証し、4)表皮ケラチノサイトにおけるSema3A遺伝子の発現調節機構を解明することで、新たな難治性痒みの予防・治療法の開発を行っています。
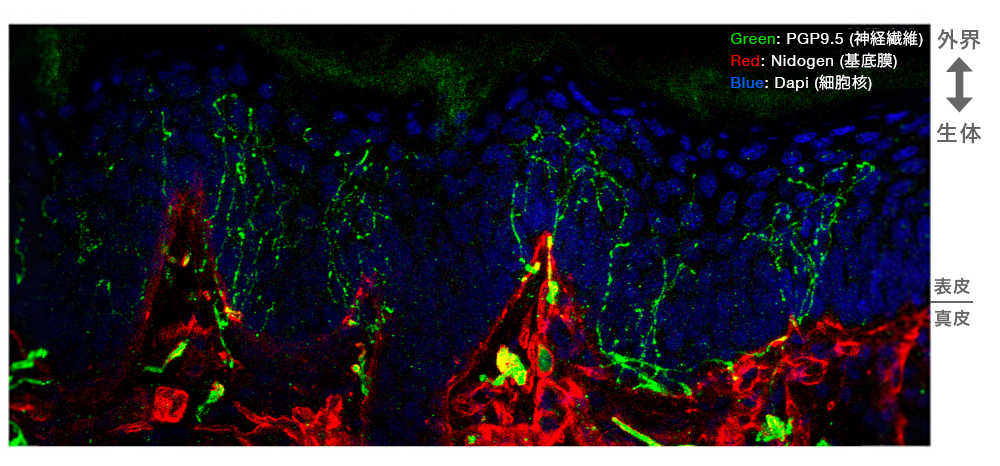 図1. アトピー性皮膚炎様病態を発症したNC/Ngaマウス皮膚
図1. アトピー性皮膚炎様病態を発症したNC/Ngaマウス皮膚
1)表皮内神経線維制御メカニズム
表皮ケラチノサイト
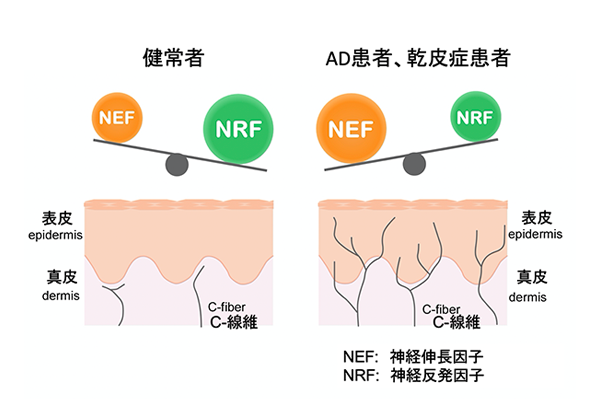
図2. 軸索ガイダンス分子のバランスによる表皮内神経線維の増生制御
神経線維
表皮‐真皮境界部に分布している神経線維が、表皮内に侵入するためには基底膜構成分子のType IVコラーゲンを分解する必要があります。神経線維は軸索円錐においてMMP2発現を増加させて基底膜を分解することを報告しました。さらに、真皮内においても、MMP8発現の増加により細胞外基質を構成するType IIIコラーゲンを分解して神経線維が伸長していくことを明らかにしました。
Tominaga and Takamori et al., J Dermatol Sci. 48, 103-111, 2007
Tominaga and Takamori et al., Br J Dermatol. 158, 842-844, 2008
Tominaga and Takamori et al., Br J Dermatol. 161, 1028-1037, 2009
Tengara and Takamori et al., J Dermatol Sci. 58, 64-71, 2010
Tominaga and Takamori et al., J Invest Dermatol. 131, 2105-2112, 2011
2)治療による表皮内神経密度の変化
ヒトAD皮膚に対するpsolaren ultraviolet A (PUVA) 療法の影響(図3)
AD皮膚では表皮内神経線維の増生、表皮NGF発現の増加、表皮Sema3A発現の減弱が認められます。これまでADに対する紫外線療法の一つであるPUVA療法はADの痒みを効果的に軽減する作用が知られていましたが、そのメカニズムはわかっていませんでした。我々は、PUVA療法前後のAD患者皮膚を解析することで、PUVA療法が表皮NGFとSema3A発現を正常化し、表皮内神経線維の増生を抑制することを明らかにしました。同様のことはNarrowband-UVB療法でも観察されました。
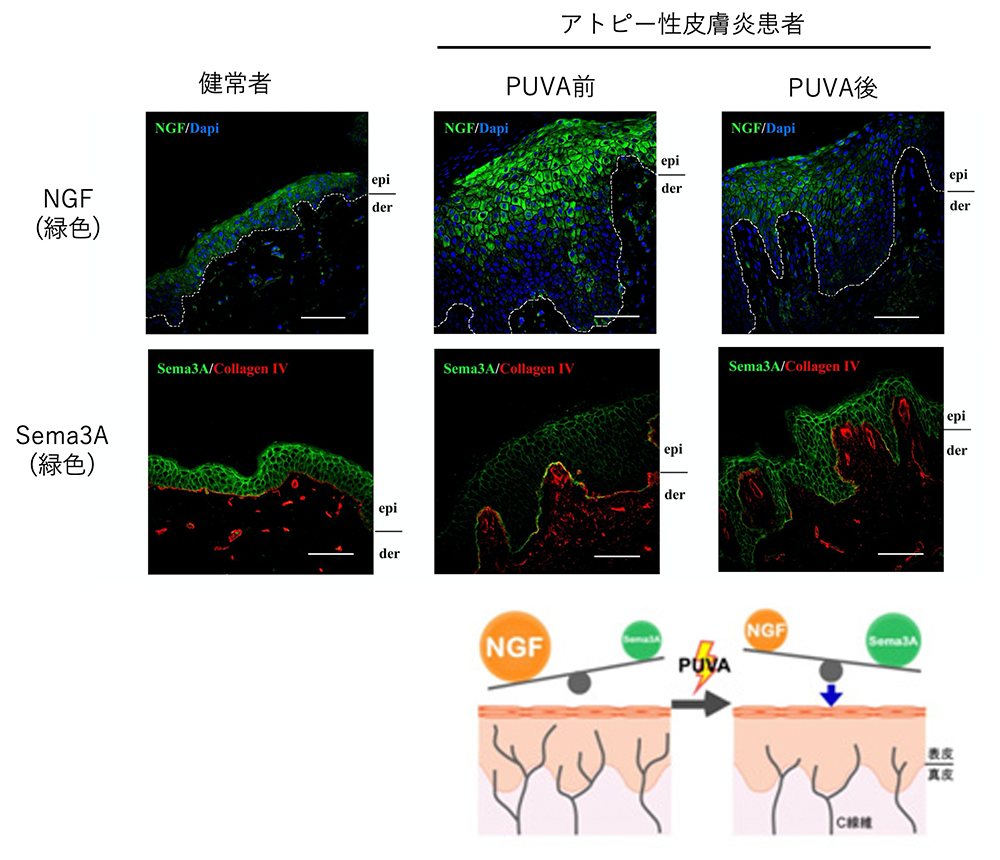
図3.PUVA療法が表皮軸索ガイダンス分子発現と表皮内神経密度に与える影響
ドライスキンモデルマウスの表皮内神経線維に対する各種治療法の影響
臨床治療で日常的に用いられている、保湿剤、ステロイド軟膏、紫外線療法の表皮内神経の増生に対する効果を横断的に検討し、臨床における痒み治療への応用を目指しました。表皮内神経線維の増生が認められる動物モデル(ドライスキンモデルマウス)に対し、治療を行い表皮内神経線維の増生抑制効果を検討しました。その結果、保湿剤<ステロイド軟膏<紫外線療法の順に表皮内神経線維の増生抑制効果が認められました。
また、ドライスキンモデルマウスの皮膚乾燥処置直後と24時間後に保湿剤を塗布した試験を比較すると、皮膚乾燥処置直後に保湿剤を塗布した方が表皮内神経線維の増生抑制効果が高いことが明らかになりました。このことは、皮膚が乾燥したら直ぐに、あるいはその前から保湿剤を使用することで皮膚乾燥に由来する痒みを予防できると考えられました。
Kamo and Takamori et al., J Dermatol Sci. 62, 64-66, 2011
Kamo and Takamori et al., J Dermatol Sci. 62, 91-97, 2011
3)Sema3A軟膏のAD病態に対する影響
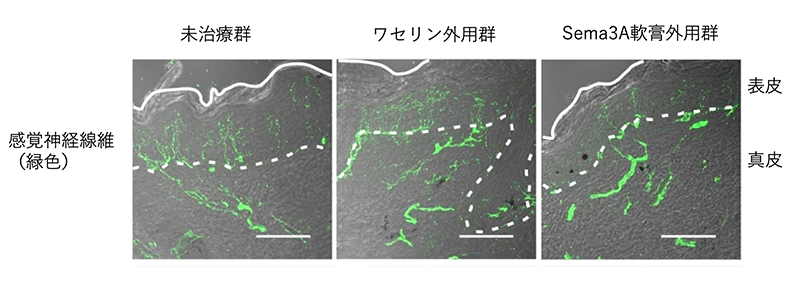
図4. Sema3A含有軟膏の表皮内神経線維の増生に対する影響
4)表皮ケラチノサイトにおけるSema3A遺伝子の発現調節機構
AD及びドライスキンなど表皮バリア機能が破綻した皮膚では、神経線維の退縮に関与するSema3Aの発現減少と表皮内神経線維の増生が認められます。先行研究で著明な効果が認められたSema3A軟膏は生産コストや製剤の安定性の面からも実用化が困難であることから、現在、表皮ケラチノサイトに発現する内在性Sema3Aの発現促進剤の開発を目指して研究を進めています。これまでの研究で、レチノイド関連オーファン受容体α作動薬であるコレステロール硫酸(図5)や、抗菌ペプチドの一種であるLL-37(図6)が表皮ケラチノサイトにおけるSema3A発現を促進することを明らかにしました。
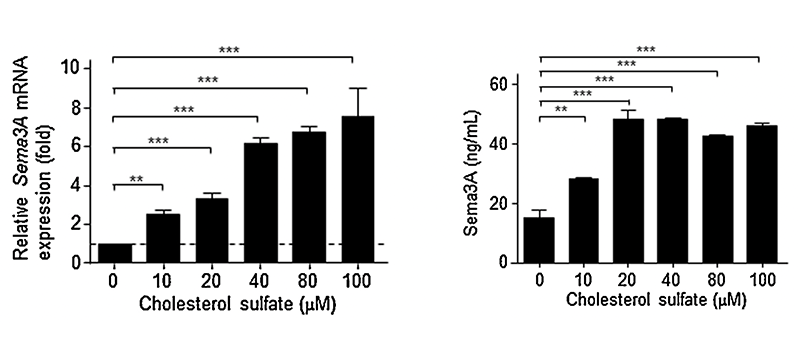
図5. コレステロール硫酸はmRNA及びタンパク質レベルでSema3A発現を誘導する
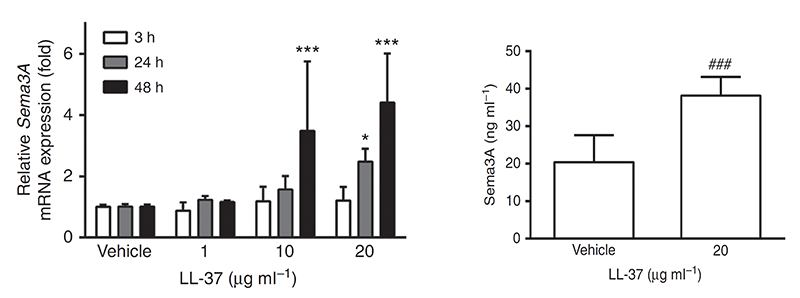
図6. 抗菌ペプチドLL-37による内在性Sema3A発現促進作用
Umehara and Takamori et al., J Invest Dermatol. 135, 2887-90, 2015
最近の研究では、Sema3A 遺伝子は角化の初期段階である有棘層の下層から基底層で発現しており、その発現調節メカニズムにはMAPK系のシグナル分子と転写因子AP-1を介することを明らかにしました (図7)。健康な表皮には顆粒層で最大となるカルシウムイオンの濃度勾配が存在しますが、Sema3A遺伝子はカルシウムイオン濃度勾配の低濃度域、すなわち表皮細胞の代謝サイクルの初期段階にあたる基底層から有棘下層に発現しています。本研究成果から、乾皮症やアトピー性皮膚炎などの疾患によってバリア機能が低下すると表皮のカルシウムイオン濃度勾配が失われ、Sema3Aの発現減少につながる可能性が示唆されました。
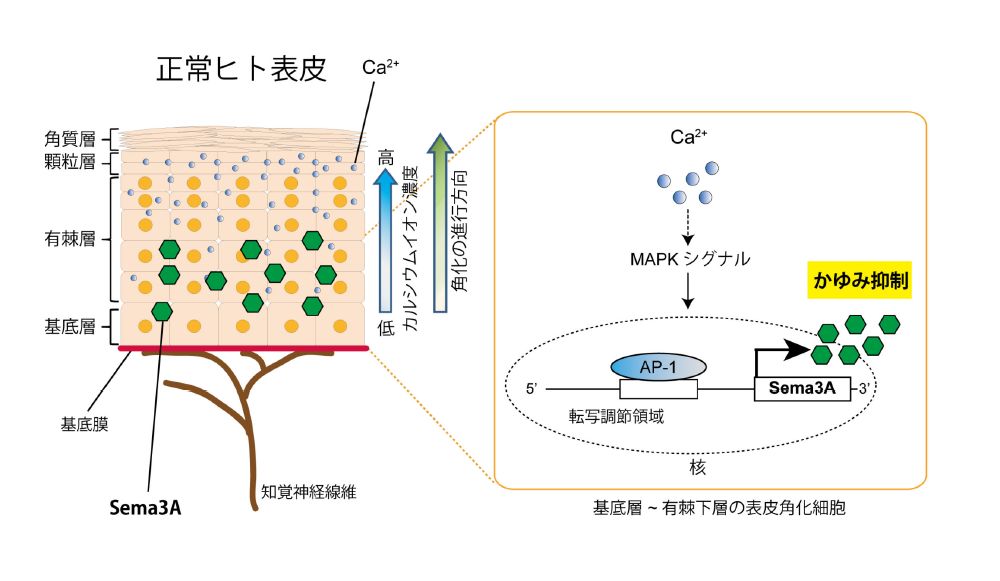
図7. 正常ヒト表皮におけるSema3Aの発現調節メカニズム
2.オピオイドペプチド-オピオイド受容体
外因性μオピオイド受容体作動薬の代表であるモルヒネは、鎮痛作用の一方で痒みを誘発することが知られています。この知見をもとに、難治性痒みの一因として、オピオイドペプチド-オピオイド受容体(オピオイド系)を介した痒みの発生機序についての研究が進められてきました。
オピオイド系の痒みは一般的にオピオイド受容体が広く分布する中枢神経系が関与する痒みと考えられていましたが、表皮ケラチノサイトのような末梢組織にもオピオイド受容体とそのリガンドが存在していることを明らかにしました。これまでの我々の研究から、1)ADと乾癬の表皮におけるオピオイド系発現、また2)PUVA療法によるAD患者の表皮オピオイド系発現への影響が明らかになりました。
1)アトピー性皮膚炎と乾癬における表皮オピオイド系発現
痒み発現に関与するオピオイド系には、痒み誘発系であるμ-オピオイド系(β-endorphin/μ-受容体)と痒み抑制系であるκ-オピオイド系(Dynorphin A/κ-受容体)があります(図1)。
AD患者の表皮では、健常者と比較して、µ-オピオイド系の発現に変化は認められませんが、κ-オピオイド系の発現が低下していました。つまり、表皮オピオイド系の発現バランスがμ-オピオイド系優位となり,痒みが誘発されていることが明らかになりました。さらに我々は、乾癬患者の皮膚生検を用いて表皮オピオイド系発現について解析を行った結果、AD患者と同様に、κ-オピオイド系発現の減少を認めました。同時に乾癬患者の表皮内神経密度の解析を行いましたが痒みとの相関が認められなかったことから、乾癬の痒みには表皮内神経線維の増生よりもオピオイドシステムの関与が強いことが明らかになりました。
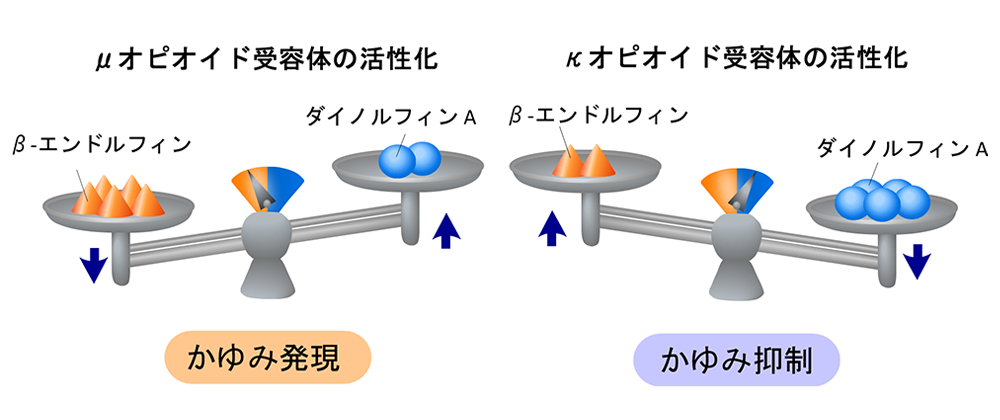
図1.オピオイド系の発現バランスによる痒み発現制御モデル
Taneda and Takamori et al., Br J Dermatol. 165, 277-284, 2011
2)治療による表皮オピオイド系発現の変化
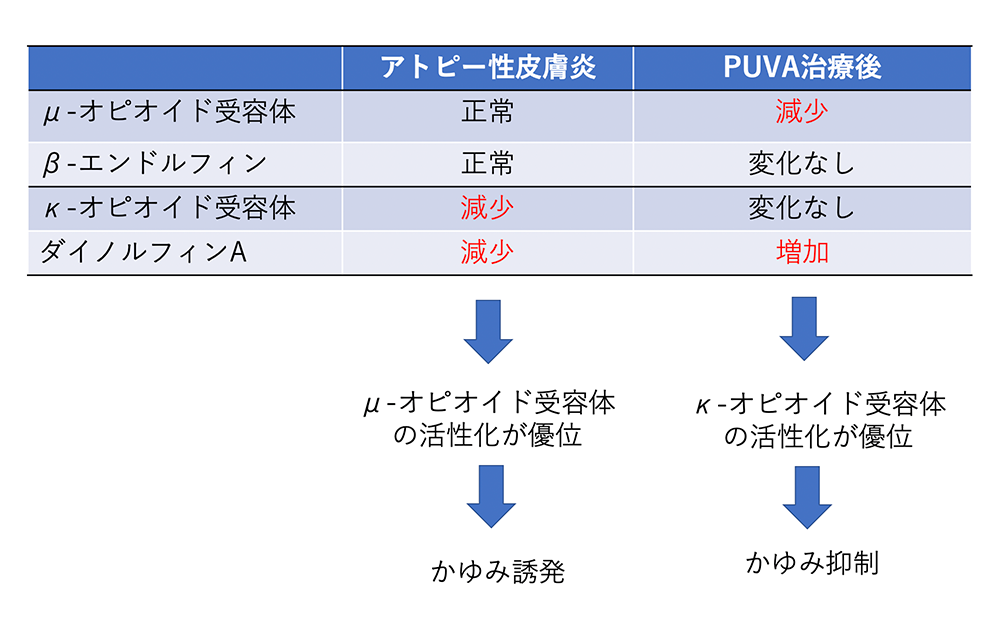
表1. PUVA療法のAD表皮オピオイドシステム発現に与える影響
3)乾癬病態モデルマウスのかゆみに対するMu-オピオイド拮抗薬及びKappa-オピオイド作動薬の影響
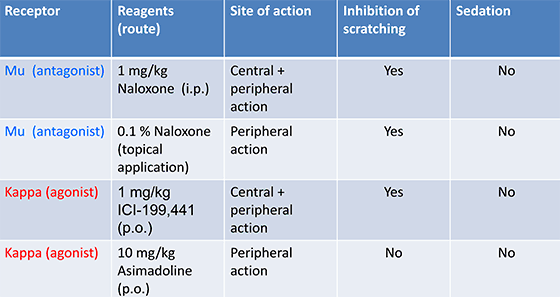
乾癬の痒みが生活の質(QOL)を著しく下げることが報告されており、近年、乾癬の痒みに対する注目度が増してきております。我々は、μ-オピオイド受容体拮抗薬(塗布及び全身投与)あるいは中枢移行性κ-オピオイド作動薬(全身投与)が乾癬様病態を発症したマウスの痒み行動を抑制することを明らかにしました。この結果は、末梢や中枢のμ-オピオイド受容体、中枢のκ-オピオイド受容体が乾癬の痒み治療の標的になることを示唆しており、今後の治療薬の開発に有用な情報であると考えられます。
4)機械的かゆみ誘発因子エンドモルフィンの同定とその分解メカニズムの解明
毛糸のセーターなどが皮膚に触れる刺激、「触刺激」によって引き起こされるかゆみは「機械的かゆみ」と呼ばれています。よく知られている現象ですが、機械的かゆみが皮膚でどうやって起こっているかはほとんど明らかになっていません。私たちは、この機械的かゆみが、Mu-オピオイド受容体のリガンド、「エンドモルフィン」によっておこることを明らかにしました。また、エンドモルフィンによる機械的かゆみは通常、ジペプチジルペプチダーゼIV(DPPIV)酵素によって分解調節されることで抑えられていることを、生まれつきDPPIV酵素を持たないCD26欠損マウスを用いて明らかにしました (図2) 。
さらに、かゆみを伴う疾患の患者さんの皮膚では、機械的かゆみに対して感受性が高くなっていること(機械的かゆみ過敏)が知られていますが、そういった皮膚でエンドモルフィンの量が増加傾向にあることも明らかにしました。
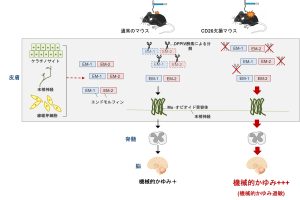
図2.エンドモルフィンによる機械的かゆみの誘発とDPPIV酵素によるその調節メカニズム
3.上皮ー神経ー免疫コミュニケーション
1)皮膚バリアの破綻による制御性T細胞の動態
界面活性剤をマウスの皮膚に塗布すると、皮膚バリアが破壊されます。界面活性剤塗布による皮膚バリア破壊モデルマウスの皮膚の解析により、免疫系の恒常性維持に働く制御性T細胞(Treg)が真皮内に浸潤していることが明らかになりました。またTregの浸潤は、アラーミンとして知られるインターロイキン(IL)-33が直接関与していることが明らかになりました (図1)。以上より、バリア破壊時、IL-33は皮膚にTregを遊走させ浸潤・集積させ、Tregは免疫抑制に働くことで炎症を起こさないようにし、皮膚の恒常性を維持していることが示唆されました。
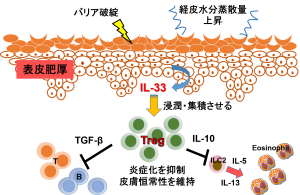
図1.皮膚バリアの破綻における制御性T細胞の役割
4.かゆみのバイオマーカーに関する研究
1)アトピー性皮膚炎の血漿グランザイムB値とかゆみ・皮膚炎の重症度の相関解析
生体内の痒みメディエーターの1つであるプロテアーゼは、プロテアーゼ活性化受容体2などの活性化を通じて、痒みを惹起します。健常者とAD患者の血液を用いた解析から、セリンプロテアーゼの一種であるグランザイムBの血中濃度はAD患者で高値を示し(図1)、痒みや皮膚炎の重症度と相関することを明らかにしました(図2)。
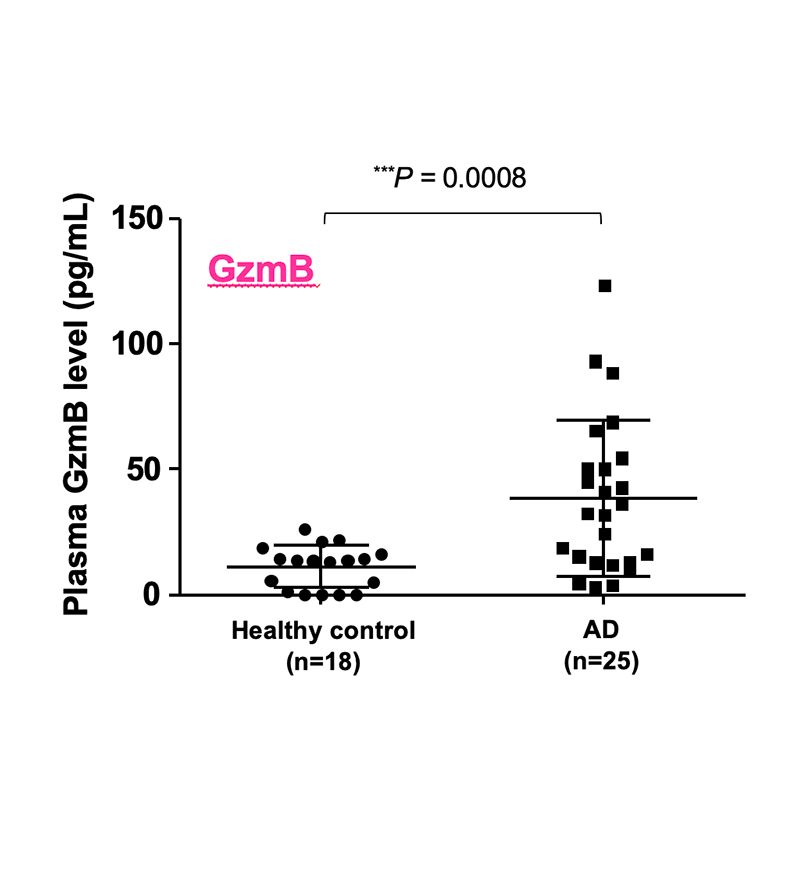
図1. 血中グランザイムB値の定量
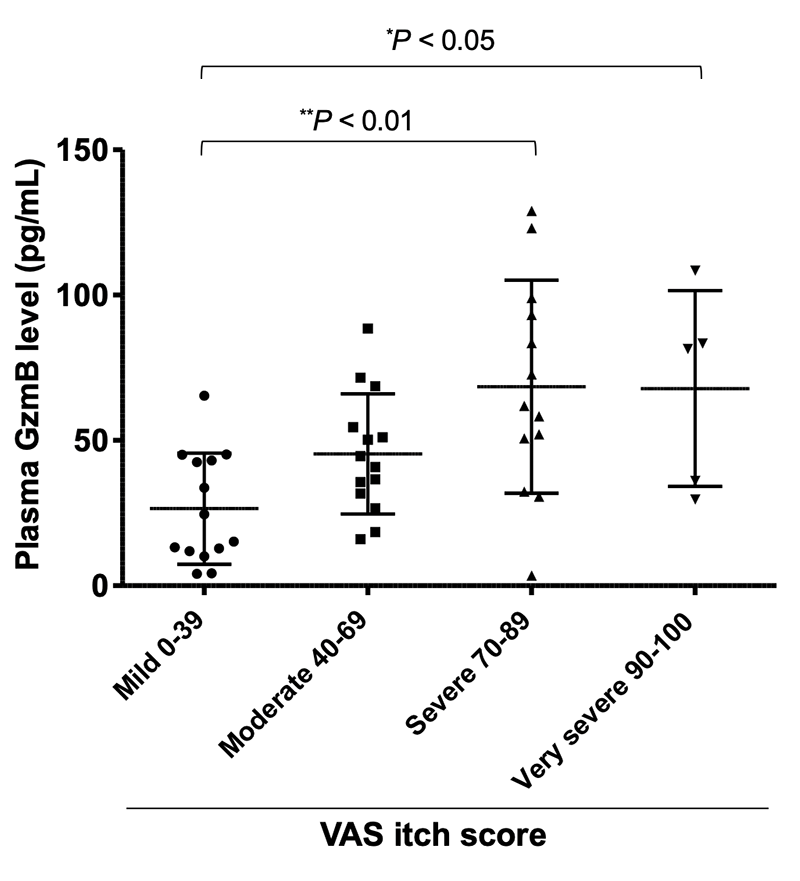
図2. 血中グランザイムB値と痒みスコアの相関
2)慢性肝疾患のかゆみの程度と血漿中ダイノルフィンA濃度の相関
慢性肝疾患は強いかゆみを呈する全身疾患の一つですが、これまでに慢性肝疾患のかゆみと相関するバイオマーカーは不明でした。これまでの研究から、β-エンドルフィンはかゆみ発現を誘発する内在性オピオイドであり、一方、ダイノルフィンAはかゆみ発現を抑制する内在性オピオイドであることが分かっていました。そこで、これらのオピオイドに着目し、慢性肝疾患患者の血漿中のβ-エンドルフィン量及びダイノルフィンA量を測定しかゆみの程度を示すVASスコアとの相関性を調べました。その結果、慢性肝疾患患者のかゆみの程度は、血漿中ダイノルフィンA量と有意な負の相関を示しました。即ち、かゆみを抑制するように働くダイノルフィンAの量が低下すると、慢性肝疾患患者のかゆみが強いことが判明しました。さらに、β-エンドルフィン量(かゆみ誘発オピオイド)/ダイノルフィンA量(かゆみ抑制オピオイド)の比を算出すると、この値が大きいほど、慢性肝疾患患者のかゆみが強く、これらの間で正の相関を示すことも明らかになりました。以上のことから、血漿中ダイノルフィンA量は慢性肝疾患のかゆみの程度を反映することが示唆されました。
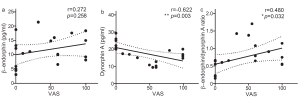
図3. 慢性肝疾患患者におけるかゆみと血漿中オピオイド量の相関関係
3)デュピルマブ治療後のアトピー性皮膚炎におけるバイオマーカーの変化
デュピルマブはアトピー性皮膚炎(AD)の炎症だけでなく、かゆみを鎮めることが知られています。デュピルマブ投与前後のAD患者の皮膚及び血清を用いて解析を行った結果、血清中thymus and activation-regulated chemokine (TARC) 、インターロイキン(IL)-22、表皮肥厚がデュピルマブによる治療効果を反映することが判明しました。また、血清中IL-31がAD患者の表皮内神経線維数を反映することも明らかとなりました。
以上より、皮膚を採取して神経線維の分布を組織学的に検査せずに血液中のIL-31量を調べることで、表皮内神経の密度を推定し、かゆみ過敏状態の有無を推測できることが可能になりました。また、血清中TARC、IL-22及び表皮肥厚がデュピルマブ治療の効果判定因子となり得ることが明らかになりました。
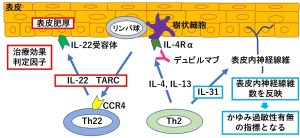
図4.アトピー性皮膚炎におけるデュピルマブの治療効果判定要素
4) かゆみを伴う様々な皮膚疾患における血漿オピオイド濃度と血清リポカリン(LCN)-2濃度の解析
皮膚疾患にはかゆみを伴うものがありますが、これまで血漿オピオイド濃度とかゆみの強さの相関は一部しか明らかになっていませんでした。そこで、アトピー性皮膚炎、乾癬、結節性痒疹、蕁麻疹、掌蹠膿疱症、皮脂欠乏性湿疹の各々におけるβ-エンドルフィンとダイノルフィンAの血漿中濃度を測定し、かゆみの程度を示すVASスコアと相関解析を行いました。健常者と比べて、β-エンドルフィン濃度は血液透析患者と皮脂欠乏性湿疹患者で高く、ダイノルフィンAは血液透析患者、皮脂欠乏性湿疹、蕁麻疹で低いという結果が得られましたが、これらの濃度とかゆみの強さの間に相関はありませんでした。
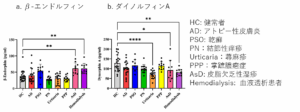
図1.かゆみのある様々な皮膚疾患における血漿オピオイド濃度の比較
一方、血清LCN-2濃度は乾癬のかゆみの強さと相関することが知られています。今回、様々な皮膚疾患における血清LCN-2濃度を測定し、かゆみの強さと相関解析を行いました。その結果、既報と同様に血清LCN-2濃度は健常者と比べて乾癬患者で高く、VASスコアならびに重症度マーカーのPASIスコアとの間に相関がありました。一方、その他の皮膚疾患(アトピー性皮膚炎、結節性痒疹、掌蹠膿疱症)における血清LCN-2濃度は、かゆみの強さとの間に相関が認められませんでした。
以上の結果より、内因性オピオイド濃度は血液透析患者や皮脂欠乏性湿疹患者で変動するものの、かゆみの強さを直接反映しないことがわかりました。一方、血清LCN-2濃度は乾癬のかゆみと重症度を示すバイオマーカーになりうることが示唆されました。
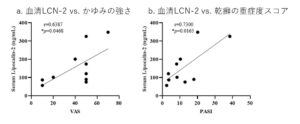
図2.乾癬患者における血清LCN-2濃度とかゆみの強さ、重症度スコアとの相関解析
5.かゆみの解析ツール
ヒトiPS cellsからの末梢かゆみ神経誘導法の開発
6.その他の痒みのメカニズム、メディエーターに関する研究
- Gastrin releasing peptide含有神経の特性化と痒み伝達メカニズムへの関与
- ヒスタミン受容体を標的としたアトピー性皮膚炎の新規止痒薬の開発
- 生体ストレスによるアトピー性皮膚炎の病態への関与
- 脊髄に着目した痒み過敏機構の解明に関する研究
- 潰瘍性大腸炎におけるかゆみの解析
- 紫外線療法が皮膚細菌叢・真菌叢に及ぼす影響
また、痒みは痛みと非常に類似した発生機序により、我々に外部異物の侵入や身体の異常を知らせてくれるサインです。そのため、最近では、痒みと痛みの相互作用に着目した研究も行っています。
我々の研究テーマに興味がありましたら是非ご連絡下さい。研究者や大学院生等、多くの方の研究への参加を希望しています。
7.その他の皮膚科学研究
1)加齢に伴う天然保湿因子(NMF)産生酵素の活性及び発現変動の解析
角層バリアを担う因子の1つであるNMFの大部分は遊離アミノ酸とその誘導体から構成されています。それらはフィラグリンの分解によって生成され、角層の水分量や皮膚表面pHを一定に保つために重要な役割を果たします。今回、健常な若年者と高齢者の角層抽出液を用いて、NMFアミノ酸産生の鍵となるブレオマイシン水解酵素(BH)の酵素活性及び発現パターンと、NMFアミノ酸産生量を解析しました。その結果、若年者と比べて高齢者のBH活性は高くNMFアミノ酸が大量に産生されている(図1)にも関わらず、角層水分量と経表皮水分蒸散量は低く、乾燥肌状態であることを明らかにしました。以上より、高齢者の皮膚においては、乾燥肌を補うため、代償的にBHの活性と発現が増加している可能性が考えられました。
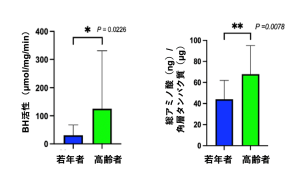
図1.若年者と高齢者の角層におけるBH活性とNMFアミノ酸量の比較
2)分子標的型抗がん剤による皮膚障害のメカニズムの解明
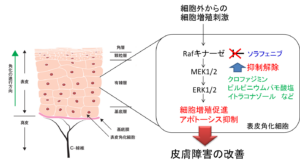
分子標的型抗がん剤は従来の抗がん剤で見られる脱毛、骨髄抑制、吐き気などの副作用が少ない反面、ニキビのようなざ瘡様皮疹、爪の周りに炎症を起こす爪囲炎、皮膚の乾燥、手掌や足底に生じる手足症候群など、皮膚に副作用が生じやすいことが知られています。しかしながら、その発症機序はよくわかっておらず、主な治療法は対症療法しかありませんでした。私たちは分子標的薬のマルチキナーゼ阻害薬の一種であるソラフェニブを用いて、約1200種類の既存薬のスクリーニングを行った結果、クロファジミン、ピルビニウムパモ酸塩、イトラコナゾールなど既存薬がソラフェニブによる表皮角化細胞の細胞障害を抑制することを発見しました。本成果は、従来、発症機序もわからず、明確な治療法がなかったマルチキナーゼ阻害薬による手足症候群などの皮膚障害に対し、新規治療法開発に役立つ可能性を示唆しました。
3)ソラフェニブによる細胞障害に対するアゾール系抗真菌薬の細胞保護メカニズムの解明
分子標的型抗がん剤の一種であるマルチキナーゼ阻害薬のソラフェニブによる皮膚障害にアゾール系抗真菌薬が細胞保護作用を示すことを解明しました。MKIの副作用は、手掌や足底などに過角化や痛みのある水疱が出現する手足症候群(HFSR)を高率に発症することが知られています。しかしながら、その発症機序や根本的な治療法は明らかにされていませんでした。研究グループはソラフェニブによる表皮細胞障害の発症機序には炎症性サイトカインの分泌促進やアポトーシス阻害因子cIAP-1の発現低下によるアポトーシスの促進が関与しており、アゾール系抗真菌薬のイトラコナゾールが細胞障害を抑制することを解明しました。また、外用薬のケトコナゾールをHFSR患者の病変部に塗布すると、症状が改善することも明らかになりました。本成果はこれまで対症療法しかなかったHFSRに対し、アゾール系抗真菌薬投与による治療法の可能性を示唆しました。
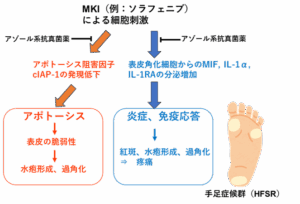
図.ソラフェニブによる細胞障害に対するアゾール系抗真菌薬による細胞保護メカニズム
8.共同研究実績
共同研究課題(委託者五十音順)
- 皮膚バリアと痒みに関する研究(花王株式会社)
- 皮膚バリアと痒みに有効な漢方薬の検討(Kracie(クラシエホールディングス株式会社))
- 表皮内神経線維と痒みに対する保湿剤の影響(佐藤製薬株式会社)
- かゆみの客観的評価に関する研究(ティア・リサーチ・コンサルティング合同会社)
- 痒み治療法の開発に関する研究(TORAY)
- 痒覚過敏に対する治療薬の影響(鳥居薬品株式会社)
- 痒み過敏に対するNTPの影響とそのメカニズムの解明(日本臓器製薬株式会社)
- かゆみ過敏に対する天然化合物の影響 (富士産業株式会社)
- 皮膚バリアと痒みに対する食品の影響(株式会社明治)
- 皮膚乾燥に対する保湿剤の影響(株式会社D&Fproject)
過去の共同研究実績(委託者五十音順)
- 表皮内神経線維に対する保湿剤の影響(株式会社 池田模範堂)
髙森建二.かゆみのメカニズムと保湿による制御のストラテジー.第111回日本皮膚科学会総会,京都,2012年6月
- 皮膚乾燥に対する衣類の効果に関する研究(一般社団法人産学連携推進協会)
- 表皮内神経線維と痒みに対する保湿剤の影響(伊那食品工業株式会社)
- 表皮内神経線維に対する光線療法の影響とそのメカニズムの解明(ウシオ電機株式会社)
Kamo and Takamori et al., Effects of excimer lamp radiation on rat dorsal root ganglion nerve fibers. 第22回国際痒みシンポジウム,東京,2012年10月
Kamo and Takamori et al., J Invest Dermatol. 134, 2977-84, 2014 - 痒みのメカニズムの解明と治療応用に関する研究(科研製薬)
- 表皮内神経線維と痒みに有効な化合物の検討(小林製薬)
- 表皮内神経線維に対する薬剤の影響とそのメカニズムの解明(ノバルティスファーマ株式会社)
冨永光俊. アトピー性皮膚炎-かゆみのメカニズム-. 第43回日本皮膚アレルギー・接触皮膚炎学会ランチョンセミナー, 金沢, 2013年12月
Ko and Takamori et al., Acta Derm Venereol. 96, 624-9, 2016 - 表皮内神経線維に対する保湿剤の影響(株式会社ファンケル)
髙森建二. かゆみのメカニズムと制御-保湿剤の有用性-. 第112回日本皮膚科学会総会, 横浜, 2013年6月
加茂敦子, 髙森建二ら. 乾燥皮膚で誘発される表皮内神経の増生に対する保湿性オリゴマーエステルD/DCの影響. 第112回日本皮膚科学会総会, 横浜, 2013年6月
Izumi and Takamori et al., J Cosmet Dermatol. 16, e37-e41, 2017 - 皮膚バリアと痒みに対する保湿テープ剤の影響(株式会社ポーラファルマ)
- 表皮内神経線維に対する保湿剤・軟膏の影響(マルホ株式会社)
- 表皮内神経線維と痒みに対する軟膏の影響(ミノファーゲン製薬・ミヤリサン製薬株式会社)
- 表皮内神経線維と痒みに対する保湿剤の影響(ロート製薬株式会社)
- AD病態に対する薬剤の影響(ヤンセンファーマ株式会社)
- 保湿剤による痒み抑制効果に関する研究(Bioderma)
