研究テーマ
1. 糖脂質の膜マイクロドメインの構造と細胞機能発現機構2. 糖脂質の膜マイクロドメイン(脂質ラフト)に着目した貪食細胞の食胞形成・成熟機構と細胞内寄生細菌の殺菌回避機構3. ホスファチジルグルコシドおよびその関連分子の白血球分化・免疫応答における役割4. リゾリン脂質を介した難治性かゆみ発症機構5. 感染経路解析と院内感染対策 (医療看護研究科としての研究テーマ)
メンバー
メンバー
-
特任教授(併任)岩渕 和久薬学部長
環境医学研究所 特任教授(併任)
医療看護学研究科 特任教授(併任) -
准教授(併任)大野 祐介薬学部 准教授
環境医学研究所 准教授(併任) -
助教(併任)花房 慶薬学部 助教
環境医学研究所 助教(併任) -
非常勤助教中村 洸太呼吸器内科学講座 非常勤助教
-
研究員李 暁佳環境医学研究所 研究員
-
米倉 あゆみ
研究内容
私たちのグループでは、糖脂質膜マイクロドメイン(脂質ラフト)の情報伝達機構の解明と、膜マイクロドメインや糖脂質代謝産物を介した感染・免疫応答機構の解明を目指した研究を展開しています。平成28年10月からは、AMED-CRESTの「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」の「グルコース関連脂質の作動機序を基軸とした疾患メカニズムの解明」(代表:上口裕之理研BSIシニアチームリーダー)において、「ホスファチジルグルコシドおよびその関連分子の白血球分化・免疫応答における役割の解明」を担当しています。
下記のテーマに興味のある研究者や・研究支援者・大学院生を求めています。是非一緒に新たな糖脂質の機能を解明していきましょう!
- 糖脂質の膜マイクロドメインの構造と細胞機能発現機構
- 糖脂質の膜マイクロドメイン(脂質ラフト)に着目した貪食細胞の食胞形成・成熟機構と細胞内寄生細菌の殺菌回避機構
- ホスファチジルグルコシドおよびその関連分子の白血球分化・免疫応答における役割
- リゾリン脂質を介した難治性かゆみ発症機構
- 感染経路解析と院内感染対策 (医療看護研究科としての研究テーマ)
1. 糖脂質膜マイクロドメインの構造と細胞機能発現機構
スフィンゴ糖脂質(GSL)は、細胞ごとに発現する種類や量が異なっているだけではなく、細胞の分化成熟に伴って発現パターンが異なっており、GSLは細胞の分化や機能と深く関わっていると考えられています。細胞膜は均質ではなく、GSLに富んだ膜マイクロドメイン(脂質ラフト)と呼ばれる脂質ドメインがあります。膜マイクロドメインは様々な受容体と会合することで、神経突起伸長や、細胞の成長、分化、アポトーシスなど多彩な細胞機能に関与することが示されていますが、その分子機構の詳細はよく分かっていません。
GSLは互いにcis相互作用することで会合する性質があります。そのため、GSLは互いに会合して細胞膜上で膜マイクロドメイン(脂質ラフト)を形成します。古くから、GSLが様々な細胞機能に関与していることが報告されていますが、脂質2重層の外側に存在するGSLがどのように細胞内へと情報を伝達するかは良く分かっていませんでした。私たちはなぜ糖鎖構造や脂質構造が異なると、機能が異なるGSLの膜マイクロドメインが形成されるかを明らかにすることに取り組んでいます。ヒト好中球の細胞膜上でラクトシルセラミド (LacCer) とグリセロ糖脂質のホスファチジルグルコシド(PtdGlc)が互いに異なる機能を仲介する膜マイクロドメインとして存在しています(Fig.1; Biofactors. 38:275-83, 2012)。このことは、糖脂質のわずかな構造特徴の違いが生物活性の違いを引き起こしていることを意味しており、細胞の発生・分化課程で発現する糖脂質の種類が変化していることと関連していることを示唆しています。
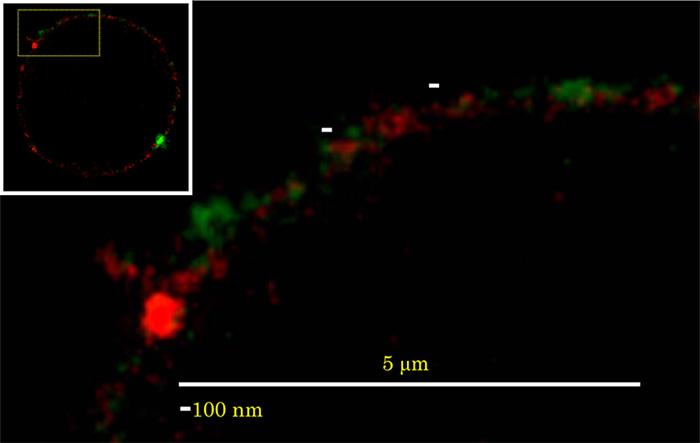
Fig. 1 Colocalization of PtdGlc and LacCer on neutrophils. Neutrophils were stained with Alexa 488-conjugated anti-PtdGlc IgM (green) and Atto425-conjugated anti-LacCer IgM (red). The stained cells were examined with a TCS STED CW confocal microscope equipped with a Plan-Apochromat 100 × oil immersion DIC objective. PtdGlc was not colocalized with LacCer on the plasma membrane of neutrophils.
(Biofactors. 38:275-83, 2012)
GSLは互いにcis相互作用することで会合する性質があります。そのため、GSLは互いに会合して細胞膜上で膜マイクロドメインを形成します。古くから、GSLが様々な細胞機能に関与していることが報告されていますが、LacCerのようなGSLは細胞膜の外側に局在しています(J Cell Sci. 128:1627-3820, 2015)。したがって、脂質2重層の外側に存在するGSLがどのように細胞内へと情報を伝達するかは良く分かっていませんでした。LacCerの融点は約70oC程度であることから、私たちの体温では固体となると考えられます。実際には、LacCerは細胞膜上でコレステロールと会合することで柔軟性を持った脂質ドメインとして存在しています。私たちは、世界で初めてセラミドの脂肪酸鎖の長さがLacCerを介した細胞機能の発現に重要であることを報告しました(Glycoconjugate J. 25: 357-74, 2008; J Leuk. Biol. 83: 728-41, 2008)。
中球に分化することができる前骨髄性白血病細胞HL60は、LacCerを細胞膜上に発現しているにもかかわらず、LacCerを介した細胞機能を発現できません(Blood. 100:1454-64, 2002)。好中球では、LacCerのマイクロドメインにSrcファミリーカイネースのLynが会合しています。LacCerにリガンドが結合すると、Lynが活性化され、好中球は遊走・貪食・活性酸素の産生を起こします。私たちは、HL60細胞の細胞膜上には炭素数24 (C24)の脂肪酸鎖を持つLacCerがほとんど無いためにLacCerを介した細胞機能が発現できないことを見いだしました(Fig.2 a)。一方、GPIアンカー型のタンパク質はC24脂肪酸のような極長鎖脂肪酸鎖を持たないため、細胞膜脂質2重層の内側の層にinterdigitationできません。また、GPIアンカー型のタンパク質はグリセロリン脂質に大きなタンパク質が結合しているためcis相互作用が弱く、GSLのような集合体を形成できません。そのため、GPIアンカー型タンパク質が細胞内へと情報を伝えるためには、膜貫通型タンパク質やLacCerの膜ドメインのような情報伝達ユニットが必要と考えています(Fig.2 b)。
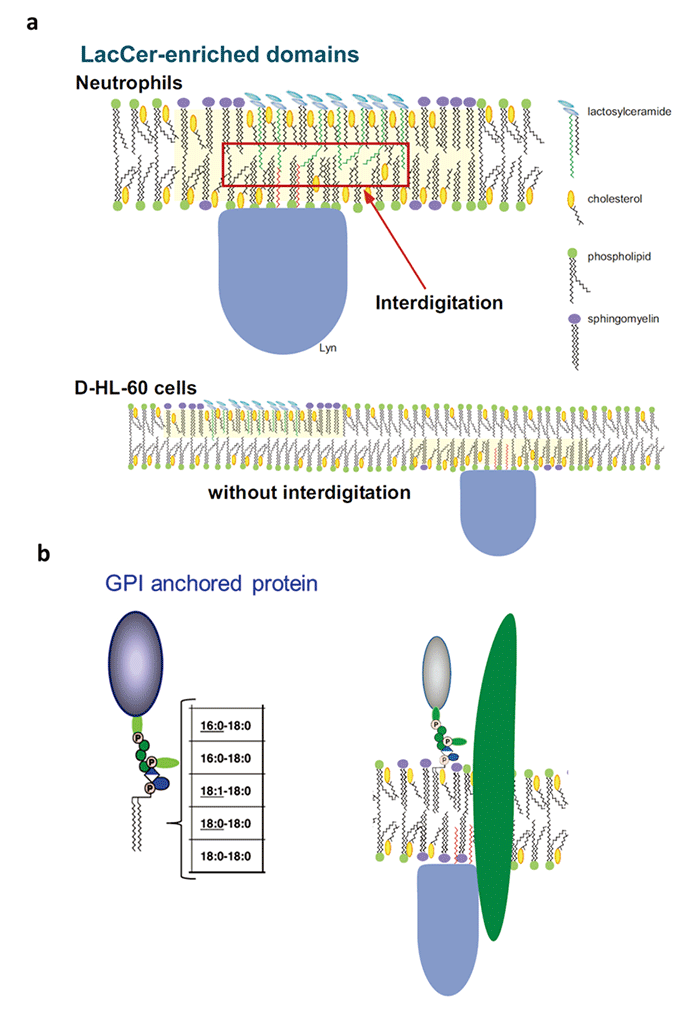
Fig. 2 (a) Glycosphingolipid (GSL)-enriched domains are more tightly packed than the surrounding liquid ordered domains of the bilayer, containing complex lipid species carrying 16-18 carbon atom acyl chains. Due to their high transition temperatures, these lipids reduce membrane fluidity and favor cholesterol segregation within the same membrane areas. The assembly of cholesterol could induce vacant pockets in the central part of the membrane, allowing interdigitation with longer alkyl chains. Due to the mismatch in lengths between cholesterol and the alkyl chains, the assembly of cholesterol could induce packing defects in their central parts. Interdigitation of C24:0- and C24:1-LacCer hydrophobic chains could occur in membrane microdomains of neutrophils, causing association of LacCer-enriched domains of external and cytoplasmic leaflets and the interaction of alkyl chains of LacCer and Lyn. In contrast, neutrophilic lineage D-HL-60 cells have only small amounts of C24 fatty acid chain-containing LacCer in their plasma membranes. Thus, LacCer cannot form Lyn-coupled membrane microdomains on the plasma membrane of D-HL-60 cells.
(b) GPI-anchored proteins or PtdGlc cannot interact directly with palmitoylated signal transduction molecules, such as Lyn. It is likely that they utilize transmembrane proteins coupled with signal transduction molecules to mediate cell functions.
脂質二重層の人工膜を使った実験から、C24の鎖長の脂肪酸鎖を持つLacCerは下側の層の流動性に影響を及ぼすことが分かっています。LacCerの膜マイクロドメインはLacCerにリガンドが結合することでLynが活性化されて、細胞内へと情報を伝達します。LacCerはヒト好中球の細胞膜上で、Src family kinaseのLynや3量体Gタンパク質であるGαiと会合した膜ドメインを形成しています。そこで私たちは、LacCerの炭素数24の脂肪酸鎖が直接それらの細胞内情報伝達分子のパルミチン鎖などと直接会合していると考え、光架橋試薬を長さの異なる脂肪酸鎖に結合させたLacCer誘導体をミラノ大学との共同で作成し、実際に会合するかどうかを確認しました。その結果、C24 脂肪酸鎖のLacCer誘導体はLynやGαi分子と架橋されましたが、C16 脂肪酸鎖のLacCerではされないことを見いだしました(J Lipid Res, 56:129-41, 2015)。この実験によって、GSLの膜マイクロドメインがGSLのC24脂肪酸鎖がLynやGαi分子のパルミチン酸鎖と直接会合する情報伝達ユニットとして存在していることを世界で初めて証明することができました(Fig. 3)。
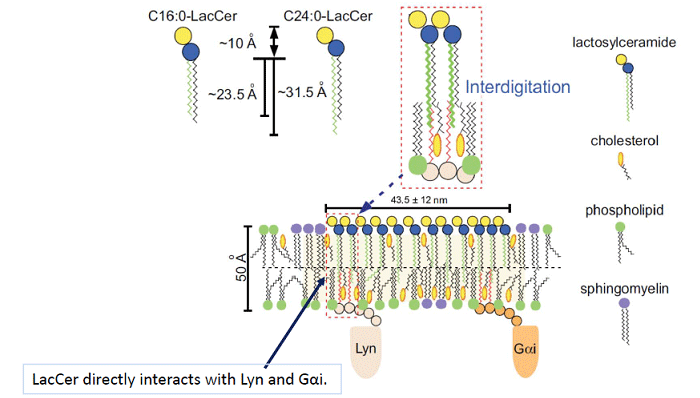
Fig. 3 C24 fatty acid chains of LacCer are directly associated with Lyn and Gαi.
LacCer-enriched membrane microdomains are enriched in complex lipid species carrying 16-18 carbon atom acyl chains that, due to their high transition temperature, participate to reduce membrane fluidity and favor cholesterol segregation within the same membrane areas. The assembly of cholesterol could induce vacant pockets in the central part of the membrane, thus allow interdigitation with longer alkyl chains. Due to the mismatch in the lengths between the cholesterol and the alkyl chains, the assembly of cholesterol could induce packing defects in the central part of them. Interdigitation of the C24:0-and C24:1-LacCer hydrophobic chain could occur in lipid rafts of neutrophils and C24:0-and C24:1-LacCerloading D-HL-60 cells causes the association of the lipid rafts of external and cytoplasmic leaflets and the interaction of alkyl chains of LacCer and Lyn and Gαi.
糖脂質膜マイクロドメインの構造特徴に基づく自己免疫疾患発症
全身性エリテマトーデス(SLE)やリウマチ等の自己免疫疾患は未だその原因を特定することが難しい病気です。自己免疫疾患の一つであるギランバレー症候群はウイルス感染や細菌感染などがきっかけとなって発症すると考えられていています。脳、脊髄、神経根、末梢神経を同時あるいは前後して広範に障害する疾患である脳脊髄根末梢神経炎(Encephalomyeloradiculoneuropathy:EMRN)はLacCerに対する自己免疫疾患です(Neurology, 82(2):114-8. 2014)。私たちはLacCerに対するモノクローナル抗体がクローンによって結合特異性や生物活性が異なることに着目して、EMRNの原因を解明するためのin vitroの実験系を確立することに成功しました(Glycobiology. 25: 655-68, 2015)。ワシントン大学の箱守仙一郎先生が同定されたLacCerに対するモノクローナル抗体であるT5A7はヒトだけではなく、マウスの好中球のLacCerにも結合することが出来ますが、市販の抗LacCer抗体の多くは反応することが出来ません。生体膜のLacCerの膜マイクロドメインの脂質組成を再構成させたリポソームを用いた表面プラズモン共鳴法やELISA法を工夫することで、T5A7はLacCerの膜ドメインの辺縁部を、他の抗体はLacCerクラスターそのものに結合しやすいことを見いだしました。私たちは糖脂質が作り出しているドメインの立体構造を特異的に認識する抗体を使って、糖脂質を介した自己免疫疾患の発生機序とその治療法の解明に取り組んでいます。
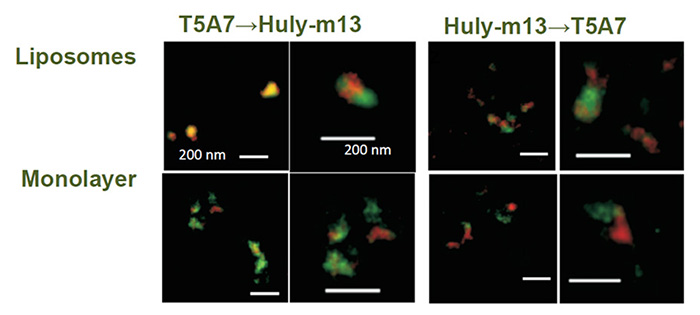
Fig. 5 STED microscopic observation of LacCer-enriched domains. Huly-m13 (red) and T5A7 (green) bound to distinct LacCer domains/clusters on the same liposomes and the same LacCer/DOPC coated plastic wells, suggesting that the binding sites for these two monoclonal antibodies are not always the same (Glycobiology 25:655-68., 2015) .
2. 糖脂質の膜マイクロドメイン(脂質ラフト)に着目した貪食細胞の食胞形成・成熟機構のと細胞内寄生細菌の殺菌回避機構
Glycosphingolipid-enriched lipid rafts mediated engulfment of pathogenic microorganisms by phagocytes and escape mechanisms of these microorganisms
自然免疫は、人間が生まれながらに持っている生体防御機構です。好中球は、生体内に侵入してきた菌体に向かって遊走し、菌に接着し、貪食するなど、自然免疫において中心的な役割を果たしています。古くより菌体がLacCerのような特定のGSLに結合することが知られています。私たちはこれまでにLacCerの膜マイクロドメインがヒト好中球の遊走・貪食・活性酸素産生に関与することを明らかにしています(Arch. Immuno. et Therap. Exp. 61:217-28, 2013)。αMβ2インテグリン分子は貪食細胞における接着・遊走・貪食反応を仲介する重要な受容体としてよく知られています。しかしながら、αMβ2インテグリンの細胞内には情報伝達モチーフがありません。そこでαMβ2インテグリンを介した細胞内への情報伝達はLynの活性化が必須である点に着目して解析した結果、Lynと会合したLacCerの膜マイクロドメインがαMβ2インテグリン分子の情報伝達プラットホームとして機能していることが分かりました(J Leuk. Biol. 83: 728-41, 2008)。
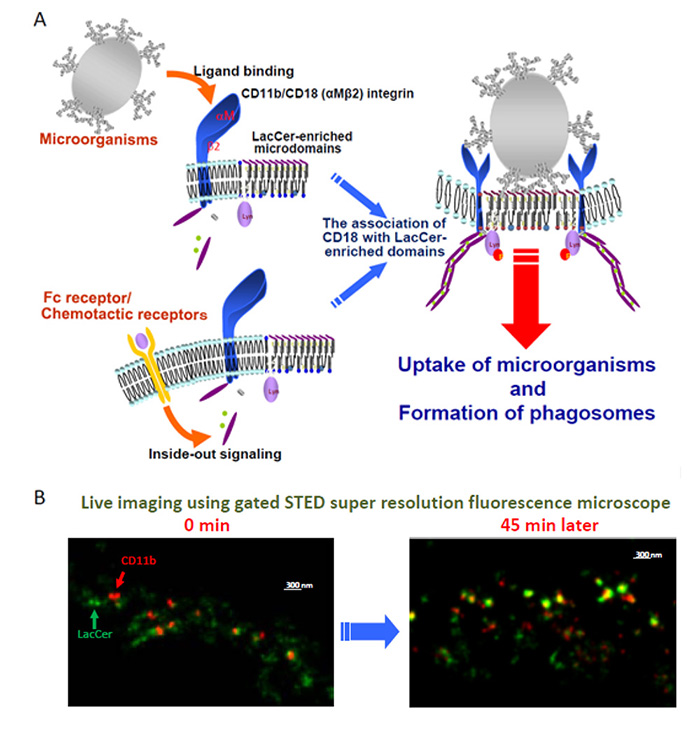
Fig. 4 Lyn-coupled LacCer-enriched membrane microdomains are indispensable for αMβ2 integrin-mediated phagocytosis.
(A) αMβ2 integrin is associated with LacCer-enriched membrane microdomains through β2 subunit, and this subunit mediates Lyn phosphorylation. Along with the binding of PAMPs expressed on microorganisms to αMβ2 integrin, the integrin molecules are activated and undergoes a conformational change. Then these integrin molecules translocates into LacCer-enriched membrane microdomains and activates Lyn molecules. These signaling cascades lead to phagosome formation.
(B) Live images of αM integrin subunit (CD11b) and LacCer using Gated STED Super resolution fluorescence microscope. Along with the incubations, CD11b went into the LacCer-enriched domains.
これまでに様々な細胞内寄生細菌が宿主細胞の細胞膜上の膜マイクロドメインに結合することで細胞内に取り込まれ、細胞内で殺菌されることを免れ感染が成立することが示されています。しかしながら、貪食細胞の自然免疫における膜マイクロドメインの役割についての詳細は未だに良く分かっていません。これまでに病原性抗酸菌の貪食にαMβ2インテグリンが関わっていることが示されています。そこで、私たちのグループでは、結核菌のように貪食されても細胞内で生き延びてしまう菌の殺菌回避機構にLacCerの膜マイクロドメインがどの様に関わっているかの解明に結核菌などの病原性抗酸菌を用いて取り組んでいます。
最近我々の研究グループは、結核菌のヒト好中球による貪食と殺菌回避の分子メカニズムについて新しい知見を報告しました(Sci Signal. Oct 11;9(449):ra101. 2016)。
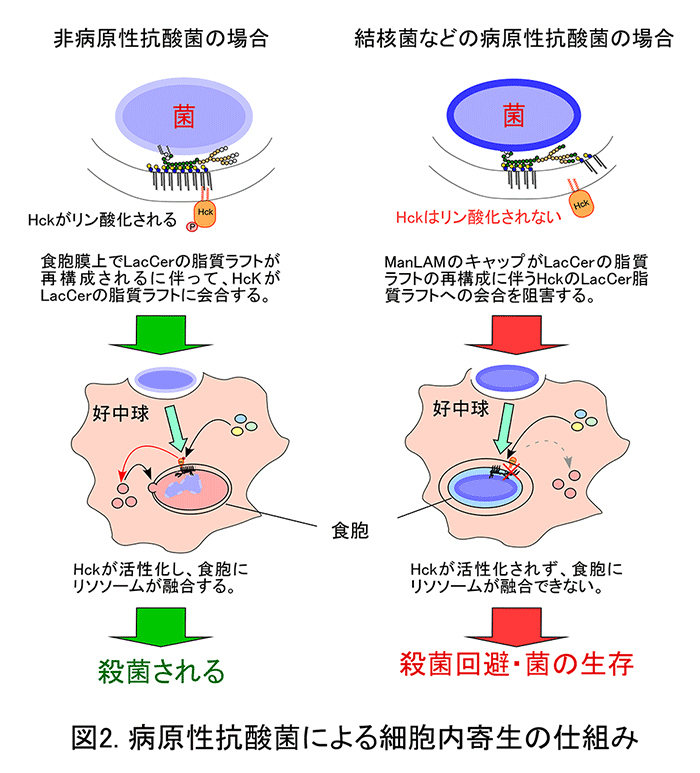
ヒト好中球による抗酸菌の貪食機構が、LacCerの脂質ラフトを介しているかどうか明らかにするため、まず、抗酸菌とLacCerとの結合実験を行いました。その結果、LacCerは病原性抗酸菌であるMycobacterium avium-intracellulare complexへ特異的に結合することが分かりました。全ての抗酸菌種にはリポアラビノマンナン(LAM)と呼ばれる糖脂質が発現しており、菌の生存に必須の分子であることが知られています。また、LAMには、マンノースがα1,6結合で繋がった糖鎖の所々に、マンノースがα1,2結合したマンナンコアと呼ばれる糖鎖が存在することが知られています。一方、従来から、LAMには、結核菌のような病原性抗酸菌が持つマンノースキャップ型LAM(ManLAM)以外に、ホスファチジルイノシトールキャップ型のLAM(PILAM)やキャップ構造の無いLAMが存在することが知られています。そして、このキャップ構造の違いが、抗酸菌の病原性、すなわち、食胞へ殺菌酵素を含むリソソームが融合することを阻害しているメカニズムと関係しているのではないかと考えられてきました。このような背景から、我々はLacCerと抗酸菌由来LAMが結合するかどうか検討しました。その結果、LacCerは病原性に依らず抗酸菌のLAMに結合することが分かりました。そこで、全抗酸菌間の共通の構造であるα1,2マンノース側鎖を欠失させた非病原性のM. smegmatis の変異株を作成したところ、好中球は変異株を貪食することが出来ませんでした。さらに、変異株由来のLAMだけがLacCerに結合できず、変異株由来のLAMをコートしたビーズも貪食されませんでした。このことは、全ての抗酸菌はLAMのマンナンコアとLacCerの脂質ラフトの結合を介して好中球に貪食されて、食胞が形成されることを示しています。
次に、PILAMをコートしたビーズを好中球に貪食させると、LacCerの脂質ラフトにはHckと呼ばれる細胞内シグナル伝達分子が会合して活性化され、食胞へリソソームが融合しました。一方で、ManLAMをコートしたビーズでは、HckがLacCerの脂質ラフトに会合しませんでした。また、食胞とリソソームの融合も起こらなくなりました(下図参照)。このことは、結核菌などの病原性抗酸菌はManLAMのマンノースキャップ部分を利用して、LacCerの脂質ラフトがHcKと会合することを阻害し、リソソームの食胞への融合を回避することを示しています。以上の結果から、ヒト好中球はLacCerとLAMのマンナンコアとの結合を介して抗酸菌を貪食すること、および、食胞に取り込まれた病原性抗酸菌はManLAMのマンノースキャップを使ってLacCerの脂質ラフトの食胞膜上での形成を阻害することで、殺菌を回避することが明らかとなりました。
この研究により分かった病原性抗酸菌が標的とするメカニズムは、従来の結核治療薬がターゲットとする作用機序とは異なっていました。したがって、今回の成果を応用することで、新たなアプローチからの多剤耐性結核治療薬や非結核性抗酸菌感染症治療薬の開発に繋がると考えられます。現在、ManLAMが標的とするLacCer関連シグナル伝達経路をさらに解析しているところです。
3. ホスファチジルグルコシドおよびその関連分子の白血球分化・免疫応答における役割
PtdGlcはグリセロリン脂質にグルコースが結合したグリセロ糖脂質であり、C18:0 とC20:0の アルキル鎖で構成されていることから、細胞膜上でGPIアンカー型糖タンパク質同様に膜マイクロドメインを構成する。PtdGlcの脂肪酸鎖はGPIアンカー分子と同様に飽和な脂肪酸鎖でできており、細胞膜上で膜マイクロドメインを形成し、好中球の分化に関与することが報告されています。私たちのグループは、PtdGlcがLacCerとは異なる膜マイクロドメインを細胞膜上に形成すること; PtdGlcが好中球分化の最終段階であるアポトーシス誘導に関与することを発見しました(J Immunol 186: 5323-32, 2011)。PtdGlcはFasと細胞膜上近接して存在しています。PtdGlcにリガンドが結合すると、PtdGlcとFasが大きなクラスターを形成し、Fasの細胞内ドメインが活性化され、caspase-8, caspase-9, caspase-3が順次活性化されて、好中球はアポトーシスを起こします(Fig.4)。
PtdGlcは白血球や神経細胞の分化誘導に関与するといわれています。また、細胞が活性化されると、PtdGlcはリゾ体となって放出され細胞間情報伝達分子となることが明らかとなっています(Science. 349(6251): 974, 2015)。私たちはPtdGlcを介した細胞の分化・アポトーシス機構の解明を目指しています。
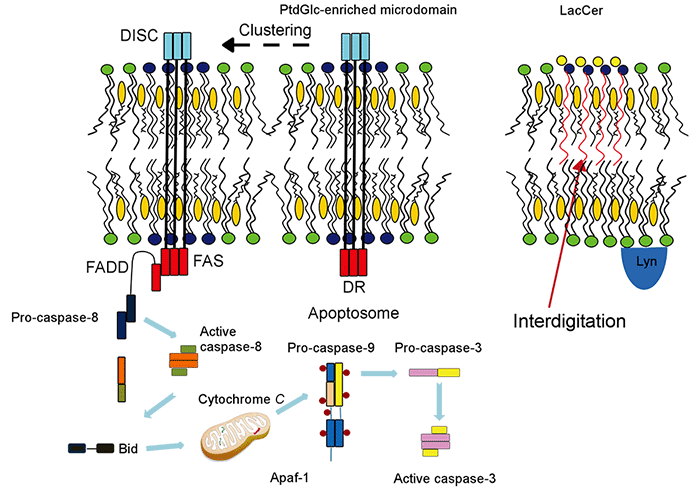
Fig. 6 PtdGlc forms membrane microdomains and is involved in Fas-dependent neutrophil apoptosis.
The binding of anti-PtdGlc antibody to PtdGlc induced large cluster formation with Fas, resulting in recruitment of adaptor molecules, such as Fas-associating protein with death domain (FADD) and caspase-8, to form death-inducing signaling complex (DISC). Then procaspase 8 undergoes autocatalytic activation, and subsequently activates capase-9 and caspase-3, resulted in apoptosis of neutrophils. (Inflammation and Regeneration 32: 213-221, 2012)
4. リゾリン脂質を介した難治性かゆみ発症機構
GSLの脂質成分であるセラミドは、皮膚における主要な細胞間脂質成分であり、皮膚の保湿能やバリア機能に重要な役割を果たしています。アトピー性皮膚炎(AD)患者の皮膚角層ではセラミド含量が減少しており、このことが乾燥皮膚ならびに角層のバリア機能異常の原因の一つとして考えられ、ADの特徴とされています。これまでに、AD患者の皮膚においてセラミダーゼ活性が高頻度に検出され、AD患者からセラミダーゼ産生菌の緑膿菌が分離されています。この様にバクテリアが産生するセラミダーゼがAD患者における皮膚セラミドを分解することにより、バリア機能が低下しADの増悪に関与することが指摘されています。しかしながら、セラミド代謝産物が痒みに関わる免疫応答にどのように関わっているかは不明でした。セラミドはセラミダーゼによって脂肪酸とスフィンゴシンに分解されます。脂肪酸はケラチノサイトや病原微生物の栄養分として取り込まれますが、スフィンゴシンはさらに代謝されてスフィンゴシ1リン酸(S1P)となります。またS1Pはケラチノサイトの遊走因子となります。近年、S1PがTNF-α産生などの炎症性サイトカイン産生に重要な役割を果たすことが報告されています。TNF-αはバリア機能に関与する様々な分子の生合成を抑制することでADを増悪させ、痒みを生じることが指摘されています。しかしながら、ケラチノサイトを起点とする痒みなど様々なADに特徴的な症状発生におけるS1P等のセラミド分解産物の役割はほとんど判っていません。そこで、バリア機能をもった角質層を形成した三次元培養ヒト正常ケラチノサイトを用いて、AD患者由来緑膿菌由来セラミダーゼによるケラチノサイトの免疫応答に及ぼす影響を解析しました(PLoS One 10.1371/journal.pone.0089402, 2014)。
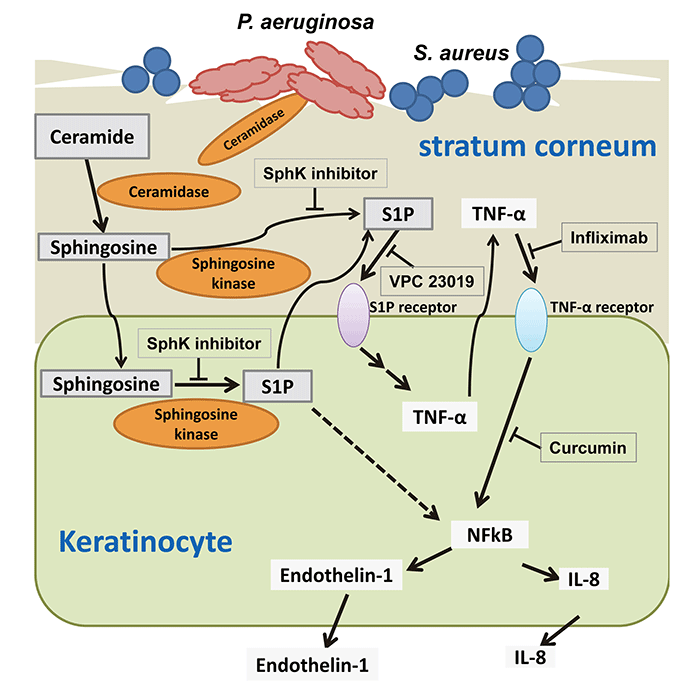
AD患者皮膚のよう角質層が痛んだ状態を、界面活性剤であるTriton X-100を用いて実験的に作り出した培養条件下で、ケラチノサイトは緑膿菌由来セラミダーゼによりTNF-αを産生させました。このTNF-α産生は、Triton非存在下では起こらなかったことから、角層が障害を受けることで、セラミダーゼが作用してケラチノサイトが反応したためと考えられました。また、セラミド分解物について検討を行ったところ、スフィンゴシン(SG)とS1P産生上昇がケラチノサイトのTNF-αとIL-8の産生上昇を引き起こすことが判明しました。したがって、セラミダーゼによって角層セラミドが分解されると、スフィンゴシンがケラチノサイトでS1Pとなり、ケラチノサイトに炎症応答を誘導すると考えられました。また、DNAマイクロアレイ解析をしたところ、TNF-αやIL-8だけではなく、痒みを誘発することが報告されているendothelin-1 などの様々な炎症性サイトカインやケモカイン遺伝子の発現が上昇することが分かりました。Endothlin-1は神経細胞に働きかけて、ヒスタミン非依存性のかゆみ刺激を引き起こします。セラミダーゼによる炎症性サイトカイン・ケモカインの産生を更に詳しく調べた結果、ADの角層において、緑膿菌が産生するセラミダーゼがセラミドを分解し、生成されたスフィンゴシンがケラチノサイトにおいてS1Pに変換され、生成されたS1Pはその受容体を介して、ケラチノサイトを刺激することにより、TNF-αを産生し、細胞外へと放出されたTNF-αが、TNF-α受容体を介してendothelin-1やIL-8等の炎症性サイトカインやケモカインを産生すると考えられました(Fig. 7)。
PtdGlcは好中球以外にも樹状細胞に発現しています(J Immunol 186: 5323-32, 2011)。乾癬や急性期のアトピー患者の皮膚病変部にはIL-8などのケモカインによって表皮内に誘導された好中球が観察されます。また、表皮内には樹状細胞であるランゲルハンス細胞が存在しています。これらのことは、皮膚においてPtdGlcや刺激に応じて細胞から放出されるLyso-PtdGlcがこれらの皮膚疾患の進展に関与している可能性を示しています。そこで、私たちはS1PやLyso-PtdGlc等のリゾリン脂質の皮膚疾患におけるかゆみ発症機構に焦点を絞って研究を展開しています。
5. 感染経路解析と感染対策 (医療看護研究科としてのテーマ)
広く、感染症の予防・制御に関わる看護職者の役割について研究指導を行っています。感染免疫応答は、病原微生物に対する宿主側の防御反応機構です。そこで、環境中の病原微生物の存在形態、伝播経路、宿主との接触形態等によって免疫応答にとってどのようにすれば有利となるかを考え、看護職者として、院内外を問わず、広く社会において病原微生物からの侵入をどのように防御・制御できる方法の開発を目指しています。
主な共同研究機関
- Department of Medical Biotechnology and Translational Medicine, Interdisciplinary Laboratory for Advanced Technologies (LITA)、University of Milano, (Italy)
- 理化学研究所脳科学総合研究センター神経膜機能研究チーム
(http://www.riken.jp/r-world/research/lab/nokagaku/circuit/senior/hirabayashi/index.html )
) - 東北薬科大学分子生体膜研究所機能病態分子学教室
(http://www.tohoku-pharm.ac.jp/homepages/kinoubyoutai/TOP.html )
)
