メンバー
浦安病院 膠原病内科
-
森本 真司膠原病・リウマチ内科(浦安病院) 教授
-
池田 圭吾膠原病・リウマチ内科 (浦安病院) 准教授
環境医学研究所運営委員 -
鈴木 智膠原病・リウマチ内科(浦安病院) 助教
-
西 卓也膠原病・リウマチ内科(浦安病院) 助手
(2020年度修了生) -
片岡 裕子膠原病・リウマチ内科 非常勤助手
(2021年度修了生) -
篠浦 まりな
環境医学研究所
-
准教授早川 国宏環境医学研究所 准教授
-
研究補助藤城 真樹環境医学研究所 技術補助員・研究生
大学院生
-
大学院生斉藤 優奈環境・性差医学 博士課程2年生
過去の在籍者
-
関川 巖膠原病・リウマチ内科学講座 元名誉教授
環境医学研究所 元副所長 -
川﨑 美紀子環境医学研究所・研究協力者
-
平井 琢也膠原病リウマチ内科学・研究協力者 (膠原病・リウマチ内科 非常勤助教)
(2016年度修了生) -
津島 浩膠原病リウマチ内科学・研究協力者(順天堂大学医学部附属静岡病院・膠原病リウマチ内科・助教)
-
作間 渉太膠原病・リウマチ内科 助手
(2020年度修了生) -
富田 裕之(2023年度修了生)
研究内容
研究の概要
私たちの研究グループでは、関節リウマチ(Rheumatoid Arthritis: RA)や全身性エリテマトーデス(Systemic Lupus Erythematosus; SLE)などの膠原病・自己免疫疾患について基礎医学と臨床医学の両方に軸足を置いた研究を行っています。また文部科学省の戦略的研究基盤形成事業の当研究所での研究テーマである“難治性かゆみ”に関連して、アトピー性皮膚炎(Atopic Dermatitis)や乾癬(Psoriasis)などについての研究も行ってきました。
研究を行っていく中で、こうした疾患(RAと乾癬、SLEとアトピー性皮膚炎など)の間には 病因的な類似性のあることも分かってきました。当研究所の設立時からの研究テーマの中心には、疾病発症の①性差と②環境要因があります。前者についてはSLEなど膠原病の発症性差について、また後者については脂質などの栄養と疾患発症の関連性についての研究を行っているほか、遺伝子以外の疾患発症統御系(マイクロRNAなどのEpigenetics)の関与について検討しています。
私たちは、実際に起きている臨床現場での様々な事象から得られる情報と、基礎医学研究で得られる知見から、こうした膠原病や皮膚疾患など慢性炎症性疾患の原因追究や、活動性の指標となる有用なバイオマーカーや新たな治療法の開発などについての研究に力を注いでいます。これらの疾患の病因や病態はきわめて複雑で未だ不明な点も多いために、研究には遺伝子やタンパク質の網羅的な解析方法(Omics解析)など最新の生物情報科学的(Bioinformatics)な方法を積極的に取り入れています(図1)。具体的な研究テーマは以下に記載しています。
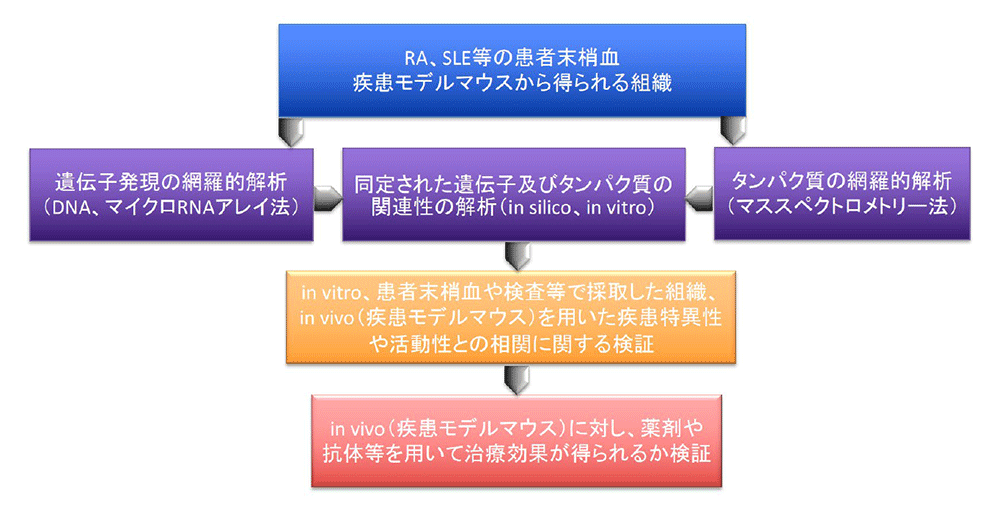
図1 研究の概要
現在進行中の研究テーマ一覧
これまでの研究の流れと今後の計画
1. 全身性エリテマトーデス(SLE)に関連した研究
SLEやRA、シェーグレン症候群等の膠原病は女性に圧倒的に多く発症することがわかっていますが、この発症性差について、エストロゲンなど性ホルモンの影響に着目し、女性の性周期や疾患の活動期・非活動期の患者末梢血リンパ球を用いた、遺伝子発現の変動をDNAマイクロアレイ法で解析を始めました。この研究によって、SLEでは従来から疾患活動性と関連があることが知られていたインターフェロンの関連遺伝子群に加え、その細胞内シグナル伝達経路に関連する様々なタンパク質の遺伝子発現の変動が疾患活動性に関与していることが明らかとなりました(Kawasaki M, Clin Exp Rheumatol, 2010 )。
SLE患者でのインターフェロンの関連遺伝子群などの制御には、JAK(Janus kinase)およびSTAT(Signal transduction and activator of Transduction)を介したシグナル伝達の異常が関連していることが示されました(Kawasaki M, Lupus, 2011 )(図2)。そこでJAK阻害薬によるシグナル伝達制御の有効性について検討し、疾患モデルマウス等を用いた研究で、JAK阻害薬がSLEの新たな治療法になりうることを証明しました(Ikeda K, BMC Immunol, 2017 )。また、B細胞の異常はSLEの病態において重要であり、近年登場した生物学的製剤であるベリリムマブ(抗B cell activating factor (BAFF)抗体)による治療効果に関する研究も進めています。特に、BTLA(B- and T-lymphocyte attenuator)を発現するメモリーB細胞の割合が、ベリリムマブによるSLEの改善と関連していることを示し、治療応答性の予測バイオマーカーとしての可能性を示唆しました(Nishi T, Int J Mol Sci, 2025)。
現在、様々な癌や高脂血症、ウイルス感染症との相関が明らかとなってきており、一部治療への応用研究がなされているmiRNAに注目し、現在疾患に関連したmiRNAの探索とバイオマーカーとしての利用可能性に関して研究しています。これまでに得られたSLEの研究結果を応用し、それらの結果に関連するmiRNAを中心に探索と解析を進めています。また、これまでに得られた知見を元に疾患モデルマウス等を用い、SLEの発症機序や新たな治療に関する研究を継続しています。
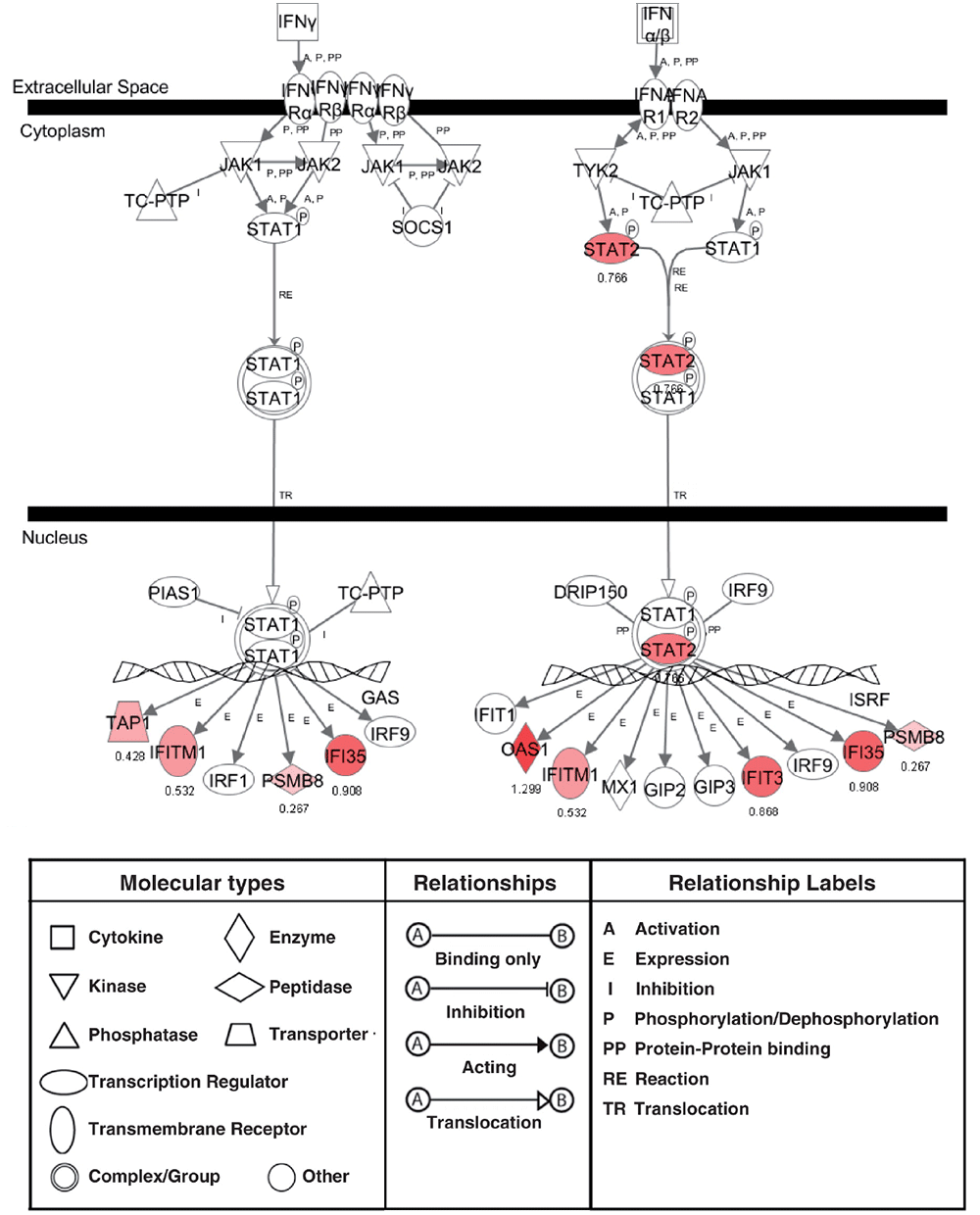
図2 SLEの疾患活動性の変化により変動した遺伝子のパスウェイ解析結果(Kawasaki M, Lupus, 2011 )
2. 関節リウマチ(RA)に関連した研究
RAにおけるTNF-αやIL-6、もしくはそれらの受容体などを標的とした生物学的製剤による治療で、比較的短期間にRAの活動性が抑制され、症状が速やかに改善されることに着目し、その経過で変動するタンパク質の網羅的解析を行う目的で、マススペクトロメトリー法による解析を末梢血で実施しました。その結果、我々はConnective tissue growth factor(CTGF/CCN2)というタンパク質を見出し、CTGFが関節破壊に関連することがわかりました(Nozawa K, Arthritis Res Ther, 2009 )(図3)。
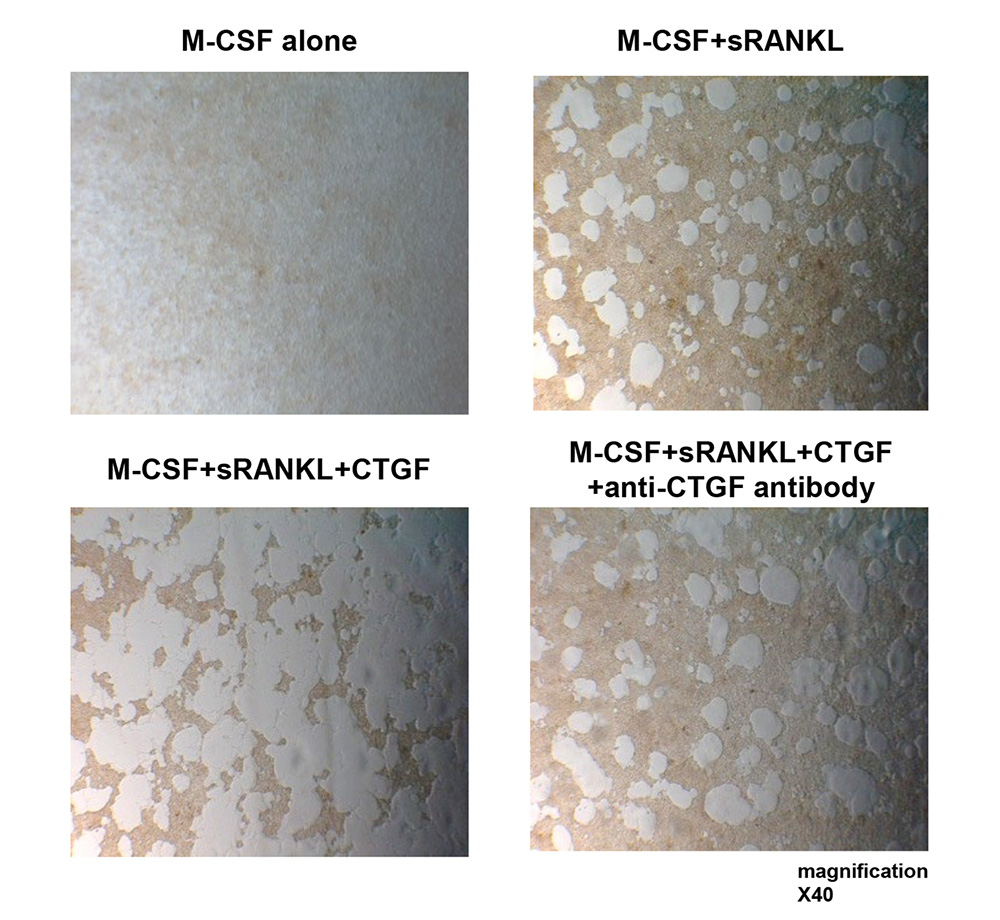
図3 破骨細胞による骨吸収はCTGFの添加により促進されるが、CTGFを抑制すると骨吸収も抑制される(Nozawa K, Arthritis Res Ther, 2009 )
次いで疾患モデルマウスや破骨細胞、滑膜細胞を用いたin vitroの実験モデルによる研究で、抗CTGFモノクローナル抗体やIGF1受容体チロシンキナーゼ阻害剤がRAの新たな治療となりうることを示しました(Nozawa K, Arthritis Rheum, 2013 )(図4) (Suzuki S, Autoimmunity, 2015 )(Tsushima H, Autoimmunity, 2017 )。
抗CTGFモノクローナル抗体に関しては以下のサイトをご参照下さい。
https://labchem-wako.fujifilm.com/jp/category/00796.html (富士フイルム和光純薬株式会社)
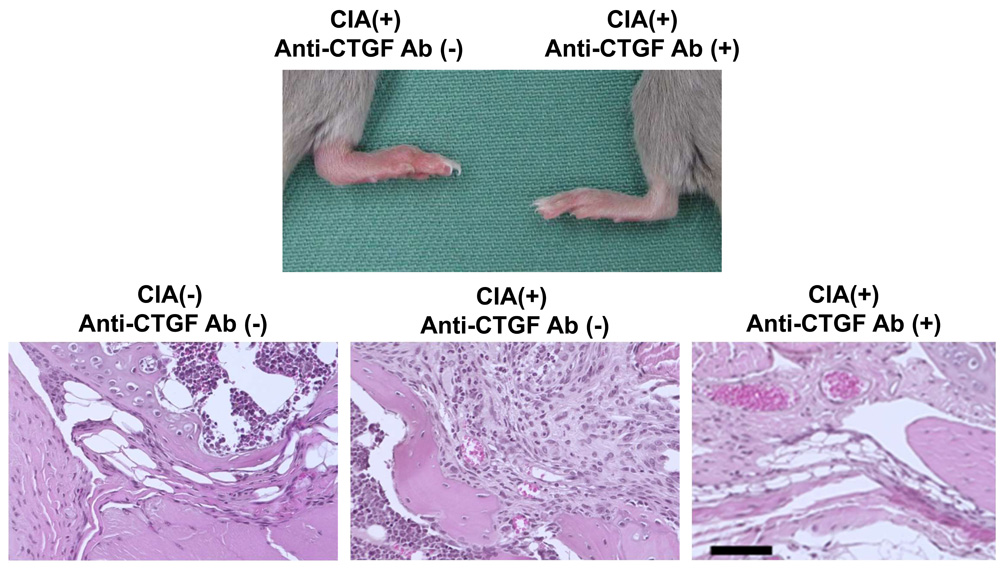
図4 抗CTGF抗体の投与はコラーゲン誘導関節炎 (CIA) マウスの関節炎を顕著に抑制する(Nozawa K, Arthritis Rheum, 2013 )
また、RA患者血液検体を利用し、miRNAアレイを行い、治療前後で変化するmiRNAには、炎症抑制に寄与するmiRNA (hsa-miR-766-3p) が含まれることを明らかにしています (Hayakawa K, Int J Mol Sci, 2019 )。
また、メトトレキサートを中心とした合成抗リウマチ薬(sDMARDs)は費用対効果やこれまでの膨大な臨床経験から、依然RA治療の中心的存在です。我々はこれらsDMARDsの複数を併用した治療が高い有効性を示すことをin vitroの実験モデルや臨床研究で証明しました(Hirai T, Clin Rheumatol, 2017 )(図5)。
さらに興味深いことに、代謝調節薬のメトホルミンを使用したin vitroの実験結果から、細胞レベルでの代謝改善が、RAの予防につながることが示唆されました (Matsuoka Y, Clin Exp Rheumatol, 2021 )。
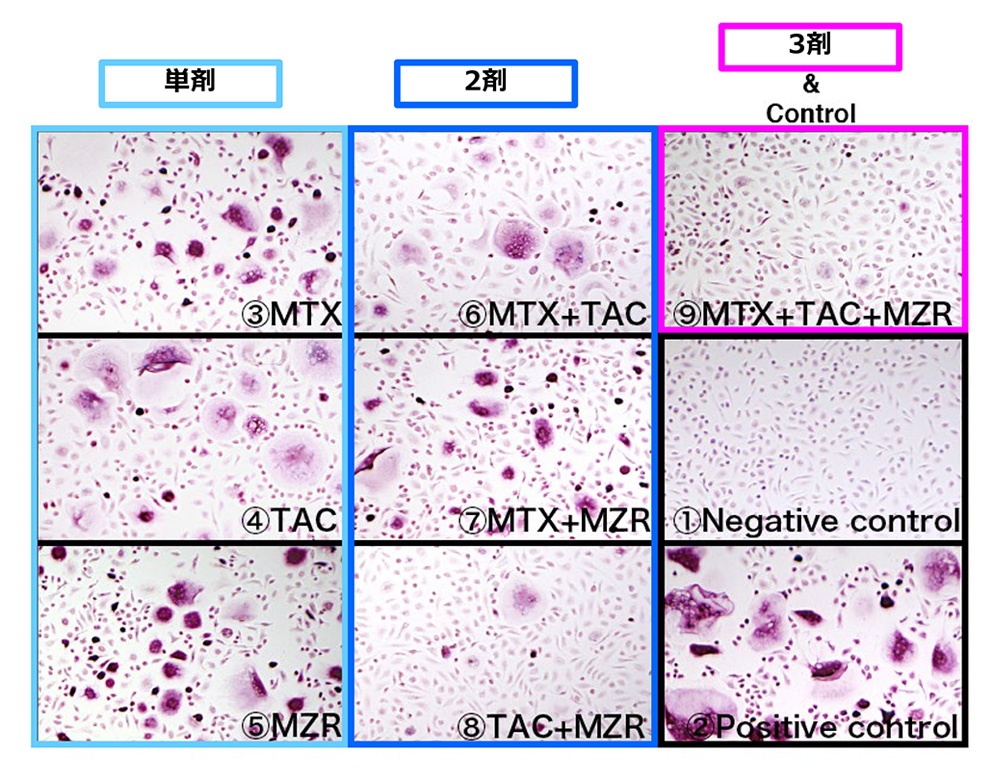
図5 合成抗リウマチ薬の併用療法(3剤)により、単剤や2剤併用より強力に破骨細胞の分化誘導が抑制される(Hirai T, Clin Rheumatol, 2017 )
3. 筋炎等その他の膠原病に関連した研究
現在、筋炎患者由来の血液検体から、疾患に関連したmiRNAを同定しています。現時点では疾患の発症や悪化などとの関連は不明ですが、疾患バイオマーカーとして利用できる可能性を報告しています(Hirai T, Inflamm Regen, 2018 )。
さらに、リウマチ性多発筋痛症 (PMR) を対象にOmics解析 (血清プロテオーム、マイクロアレイ) を行い、疾患特異的なマーカーや病因などの解明を進めています。
また、全身性強皮症を対象とした研究では、上記の抗CTGF抗体の治療効果について、モデル動物を利用して検証を行っています。
今後他の膠原病疾患で複数のOmics解析等を駆使した同様の研究を、当研究所柳田光昭准教授 (プロテオミクス研究 ) と協力し展開していく予定です。
4. 環境要因と免疫制御機構に関連した研究
前述の通り、自己免疫疾患の発症や増悪には環境要因が大きく影響します。SLEの場合、その誘因として、ウイルスなどの感染症、紫外線、外傷、ストレスなどの環境因子や女性ホルモンの関与が知られています。こうした環境因子には通常、ほぼすべての人がさらされており、大多数の健常者は自己免疫疾患を発症しません。しかし、一部の人がこうした刺激で免疫寛容破綻をきたし自己免疫疾患を発症してしまいます。その理由の一つに、同じ環境要因に曝露されたとしても遺伝的なリスクが高い場合は、疾患発症が早まったり症状が悪化したりすることを明らかにしました (Hayakawa K, Clin Exp Immunol, 2022 )。しかし、遺伝的リスクが同程度であっても発症のタイミングや症状が異なってきます。ここにまた別の環境要因が大きく影響しているものと考えられます。こうした環境要因が免疫系をどのように制御しているのかを解明するための実験モデルを作成し、メカニズムの解明を進めています。
5. 難治性かゆみに関連した研究
難治性かゆみに関連した研究プロジェクトにおいて、我々は乾癬モデルマウスを用いた実験やヒト血清を用いた解析で、乾癬におけるCTGFの関連を明らかにしました(Hayakawa K, Ann Dermatol, 2018 )。
SLE患者と同様にアトピー性皮膚炎患者の末梢血単核球ではDNAメチル基転移酵素1 (DNMT1) の発現が低下していることを以前報告しました (Nakamura T, Arch Dermatol Res, 2006 )。マイクロアレイの結果から、DNMT1の発現が低下することで、樹状細胞の活性化に関連する遺伝子群が高発現することが示唆されました。動物実験を利用し、皮膚樹状細胞のDNMT1の役割を検証した結果、特にストレス刺激 (社会的敗北ストレス) によってDNMT1の発現が低下し、アトピー性皮膚炎病態の悪化に寄与することを明らかにしました (Yoshida Y, Biochem Biophys Res Commun, 2020 )。
Overview of Our Group’s Research
Research Overview
We focus on autoimmune diseases such as rheumatoid arthritis (RA) and systemic lupus erythematosus (SLE). Bridging basic and clinical medicine, we emphasize:
・Gender differences in disease occurrence
・Environmental factors influencing disease development
・Epigenetic regulatory mechanisms (such as microRNAs)
By utilizing advanced bioinformatics techniques, including omics analysis, we aim to unravel the complex mechanisms of these diseases and develop new biomarkers and therapies.
Current Research Themes
SLE Research: Investigation of gender differences in disease onset, JAK-STAT signaling pathway abnormalities, and repositioning of JAK inhibitors as potential treatments.
Rheumatoid Arthritis Research: Identification of CTGF/CCN2 as related to joint destruction, development of anti-CTGF antibodies, and exploration of combination therapies.
Other Collagen Disease Research: Studies on myositis, polymyalgia rheumatica, and systemic sclerosis.
Environmental Factors Research: Investigation of how environmental triggers affect genetically susceptible individuals.
Intractable Itching Research: Exploration of CTGF’s role in psoriasis and DNMT1 expression in atopic dermatitis.
お知らせ
私たちの研究テーマに興味がありましたら kanken[at]juntendo.ac.jp ([at]は@に置き換えてください) までご連絡下さい。多くの方々の研究への参加を希望しています。
大学院生 (修士・博士) 【環境・性差医学】の募集に関しては、「当研究所について→大学院教育 」をご参照ください。
環境医学研究所では例年10月末ごろから12月中旬に次年度採用の博士研究員 (PD)・研究補助の募集を行っています。
本ポストの募集に興味のある方は、上記アドレスに直接ご連絡ください。
研究グループの業績に関しては以下のリンクをご参照下さい。
個々の業績については、上記メンバーの 研究者情報データベースおよびresearchmap リンクからご参照ください。
